在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。下列热化学方程式正确的是( )
| A.CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l);△H=+725.8kJ·mol-1 |
| B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);△H=-1452kJ·mol-1 |
| C.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);△H=-725.8kJ·mol-1 |
| D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l);△H=-22.68kJ·mol-1 |
36.5gHCl溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质的量浓度为c mol/L,NA表示阿伏加德罗常数,则下列叙述中正确的是()
| A.所得溶液的物质的量浓度:HCl=1mol/L |
| B.所得溶液中含有NA个HCl分子 |
| C.常温下,36.5g HCl气体占有的体积一定为22.4L |
| D.所得溶液的质量分数:ω=36.5c/(1000ρ) |
在甲、乙、丙、丁四个烧杯中分别加入2.3gNa、6.2gNa2O、7.8gNa2O2和4.0g NaOH,而后各加入100mL水,搅拌,使固体完全溶解,则甲、乙、丙、丁溶液中物质的量浓度大小顺序正确的是()
| A.甲=丁<乙<丙 | B.丁<甲<乙=丙 |
| C.丁<乙=丙<甲 | D.丁<甲<乙>丙 |
向MgSO4和Al2(SO4)3的混合溶液中, 逐滴加入NaOH溶液。下列图象中, 能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积, 纵坐标表示反应生成沉淀的质量)( )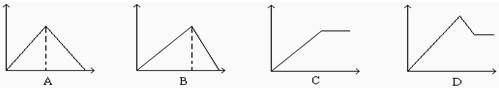
在Cu2S + 2Cu2O =6Cu + SO2↑反应中(注:Cu2S 和 Cu2O中,Cu为+1价),
下列说法正确的是()
| A.生成1molCu,转移2mol电子 | B.Cu是氧化产物 |
| C.Cu2S既是氧化剂又是还原剂 | D.氧化剂只有Cu2O |
下列各组离子在强酸性溶液中能大量共存的是()
| A.Ba2+ Na+ SCN--- Fe3+ | B.Mg2+ Cl-Al3+ SO42- |
| C.K+ Cl- HCO3- NO3- | D.Ca2+ Na+ Fe3+ AlO2- |