目前用量最大、用途最广泛的合金是______。
选择下列实验方法分离物质,将分离方法的序号填在横线上。
A萃取分液法;B加热分解;C结晶法;D分液法;E蒸馏法;F过滤法
(1)从硝酸钾和氯化钠的混合溶液中获得硝酸钾;
(2)分离水和汽油的混合物;
(3)分离饱和食盐水与泥沙的混合物;
(4)分离相溶的CCl4(沸点为76.75℃)和甲苯(110.6℃)的混合物;
铁和铁的化合物用途广泛。请回答下列问题:
(1)写出在潮湿空气中钢铁锈蚀时正极反应的电极反应式:_______________________。
将生锈的铁屑放入H2SO4溶液中充分溶解后,在溶液中并未检测出Fe3+,用离子方程式说明原因:______________________________________。
(2)爱迪生蓄电池的反应式为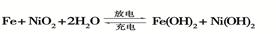
①爱迪生蓄电池的正极是, 该电池工作一段时间后必须充电,充电时生成Fe的反应类型是______。
②高铁酸钠(Na2FeO4)是一种新型净水剂。用如图装置可以制取少量高铁酸钠。写出在用电解法制取高铁酸钠时,阳极的电极反应式___________________________________。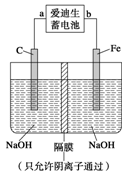
③你认为高铁酸钠作为一种新型净水剂的理由错误的是 ______。
a.高铁酸钠溶于水形成一种胶体,具有较强的吸附性
b.高铁酸钠在消毒杀菌时被还原生成Fe3+,Fe3+水解产生氢氧化铁胶体能吸附悬浮杂质
c.高铁酸钠具有强氧化性,能消毒杀菌
d.高铁酸钠具有强还原性,能消毒杀菌
(3)某FeO、Fe2O3混合物中,铁、氧的物质的量之比为4︰5,其中Fe2+与Fe3+物质的量之比为___________。
氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义。
(1)合成氨的原理为:N2(g)+3H2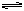 2NH3△H=" -" 92.4kJ/mol
2NH3△H=" -" 92.4kJ/mol
①将一定量的N2(g)和H2(g)放入1L的密闭容器中,在500℃、2×107Pa下达到平衡,平衡时测得N2为0.1 mol,H2为0.3 mol,NH3为0.1 mol。该条件下H2的转化率为。
此温度下该反应的平衡常数K=。
②欲提高H2的转化率,下列措施可行的是。
a.向容器中按原比例再充入原料气
b.向容器中再充入惰性气体
c.改变反应的催化剂
d.液化生成物分离出氨
(2)在2L密闭容器中,800℃时反应2NO(g)+O2(g)  2NO2(g) △H<0体系中,各成分浓度随时间的变化如图:
2NO2(g) △H<0体系中,各成分浓度随时间的变化如图: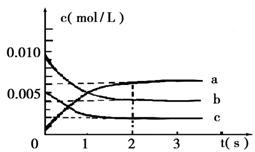
①用O2表示从0~2s内该反应的平均速率v=___________。
②能说明该反应已经达到平衡状态的是_________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内的密度保持不变
③为使该反应的反应速率增大,且平衡向正反应方向移动的是_________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
(3)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。4CO(g)+2NO2(g) 4CO2(g)+N2(g)ΔH=-1 200 kJ·mol-1对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是______(填代号)。
4CO2(g)+N2(g)ΔH=-1 200 kJ·mol-1对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是______(填代号)。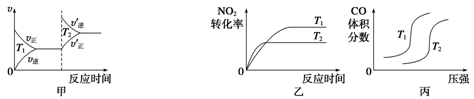
铜单质及其化合物在工业生产和科研中有重要作用。
(1)已知:2Cu2O(s) + O2(g) = 4CuO(s)△H=-292kJ·mol-1
2C(s)+O2(g)=2CO(g)△H=-221kJ·mol-1
请写出用足量炭粉还原CuO(s)制备Cu2O(s)的热化学方程式:;
(2)现用氯化铜晶体(CuCl2·2H2O,含氯化亚铁杂质)制取纯净的CuCl2·2H2O。先将其制成水溶液,后按如图步骤进行提纯: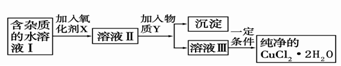
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表
| 金属离子 |
Fe3+ |
Fe2+[来源:学&科& |
Cu2+ |
| 氢氧化物开始沉淀时的pH |
1.9 |
7.0 |
4.7 |
| 氢氧化物完全沉淀时的pH |
3.2 |
9.0 |
6.7 |
请回答下列问题:
①现有氧化剂NaClO、H2O2、KMnO4,X加哪种好,为什么?
;该反应的离子方程式为。
②溶液II中除Cu2+外,还有 金属离子,如何检验其存在。
③物质Y不能为下列的
a.CuO b.Cu(OH)2 c.CuCO3d.Cu2(OH)2CO3e.CaO f.NaOH
④若向溶液Ⅱ中加入碳酸钙,产生的现象是 。
金属镁及其化合物不仅在国防上有重要应用,在化学研究中也有广泛应用。
(1)某同学研究反应速率时用如下方法:取一段镁条,用砂纸擦去表面的氧化膜,使足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图所示。镁与盐酸反应的离子方程式为;在前4min内,镁条与盐酸的反应速率逐渐加快,在4 min之后,反应速率逐渐减慢,请简述其原因:_____________。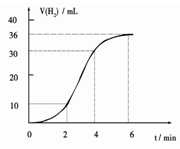
(2)向少量的Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,固体完全溶解,写出NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式。
(3)Mg Al可形成原电池:
| 编号 |
电极材料 |
电解质溶液 |
电子流动方向 |
| 1 |
Mg Al |
稀盐酸 |
Mg流向Al |
| 2 |
Mg Al |
NaOH溶液 |
根据上表中的实验现象完成下列问题:
①实验1中Mg为极;
②实验2中电子流动方向 ,Al为极,为什么? 。