研究 、
、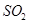 、CO等大气污染气体的测量及处理具有重要意义。
、CO等大气污染气体的测量及处理具有重要意义。
(1) 可使
可使 等氧化,常用于定量测定CO的含量。已知:
等氧化,常用于定量测定CO的含量。已知: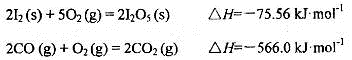
写出CO(g)与 反应生成
反应生成 的热化学方程式:________________。
的热化学方程式:________________。
(2)CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,K+移向_______极(填“正”或“负”),正极反应方程式为___________________。
(3)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷
酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料。
①该复合肥料可能的化学式为___________(写出一种即可)。
②若氨水与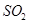 恰好完全反应生成正盐,则此时溶液呈________性(填“酸”或“碱”)。
恰好完全反应生成正盐,则此时溶液呈________性(填“酸”或“碱”)。
常温下弱电解质的电离平衡常数如下:氨水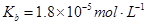 ,
,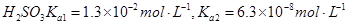
③向②中溶液中通入________气体可使溶液呈中性(填“SO2”或NH3”)。
此时溶液中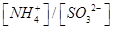 ________2(填“>”“<”或“=”)。
________2(填“>”“<”或“=”)。
(4)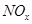 可用强碱溶液吸产生硝酸盐。在酸性条件下,FeSO4溶液能将
可用强碱溶液吸产生硝酸盐。在酸性条件下,FeSO4溶液能将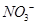 还原为NO,写出该过程中产生NO反应的离子方程式___________________________________。
还原为NO,写出该过程中产生NO反应的离子方程式___________________________________。
X、Y、Z、E、F为五种短周期元素,原子序数依次递增。X+只含有一个质子;Y的正、负化合价绝对值相等,在同族元素中其氢化物最稳定;Z的原子核内质子数是Y的最外层电子数的2倍;F与Z同主族;E与X同主族。试推断
(1)下列元素分别是: Y____, Z____,F。(用元素符号表示)
(2)X、Z、E形成化合物的电子式为 ,所含有的化学键有;它属于化合物(填“离子”或“共价”)。
,所含有的化学键有;它属于化合物(填“离子”或“共价”)。
下表标出的是元素周期表的一部分元素,回答下列问题: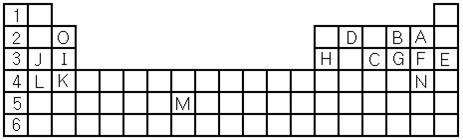
(1)表中用字母标出的15种元素中,金属性最强的是 (用元素符号表示,下同),非金属性最强的是,常温下单质为液态的非金属元素是 ,属于过渡元素的是 (该空用字母表示)。
(2)B,F,C气态氢化物中以 最不稳定。(填化学式)
(3)除稀有气体外第三周期中原子半径最小的是 。(填元素符号)
(4)写出I、H元素的最高价氧化物对应水化物的酸(或碱)性强弱顺序 > (用化学式表示)
(5)B的氢化物电子式为用电子式表示G的氢化物形成过程,(物质用化学式表示)
胃舒平主要成分是氢氧化铝,同时含有三硅酸镁( )等化合物。
)等化合物。
(1)三硅酸镁的氧化物形式为_______
(2)铝原子的原子结构示意图为,写出氢氧化铝与胃酸反应的离子方程式。
(3)Al2O3、MgO和SiO2都可以制耐火材料,其主要原因是______。
| A. Al2O3、MgO和SiO2都不溶于水 | B.Al2O3、MgO和SiO2都有很高的熔点 |
| C.Al2O3、MgO和SiO2都是氧化物 | D.Al2O3、MgO和SiO2都是白色固体 |
利用化学变化的递变规律,常可对某些物质的化学性质作出合理的推测,请判断下列各推测是否合理(填合理、不合理或不一定合理),并说明判断的理由。
(1)从红热的铜丝能在氯气中燃烧的事实,推测红热的铁丝也能在氯气中燃烧。
(2)从铁粉和硫粉加热条件下能发生反应的事实,推测铜粉和硫粉在相同加热条件下也一定能发生反应。
(3)从SO2通入Ba(OH)2溶液能产生白色沉淀的事实,推测SO2通入BaCl2溶液也能产生白色沉淀。
(4)从反应2CO2 +2Na2O2==2Na2CO3 +O2的事实,推测二氧化硫也一定能发生反应:
2SO2 +2Na2O2==2Na2SO3 +O2。
| 题号 |
是否合理 |
理由 |
| (1) |
||
| (2) |
||
| (3) |
||
| (4) |
A、D、E、M、L是原子序数依次增大的五种短周期元素。已知A是元素周期表中原子半径最小的元素;D的某种单质是天然存在的最硬物质;E是地壳中含量最多的元素;M与A位于同一主族;L与M能够形成ML型离子化合物。回答下列问题:
(1)元素D在元素周期表中的位置是。
(2)L的单质与M的最高价氧化物对应水化物反应的离子方程式为。
(3)由A、D组成的最简单化合物甲的二氯化物有种。人们已经研究出以甲为燃料的新型碱性燃料电池,写出该电池正极的电极反应式为:。
(4)已知反应:DE(g)+A2E(g) DE2(
DE2( g)+A2(g),
g)+A2(g),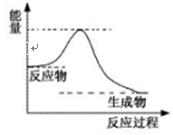
一定条件下该反应进行过程中的能量变 化如上图表示,请结合上图判断:该反应△H0(填“>”、“<”或“=”)。该反应的平衡常数表达式为:K=
化如上图表示,请结合上图判断:该反应△H0(填“>”、“<”或“=”)。该反应的平衡常数表达式为:K= 。
。
(5)25℃时,物质的量浓度相同的MEA、MADE3、MLE三种溶液,水的电离程度由大到小的顺序为。