下列指定反应的离子方程式正确的是( )
| A.向FeCl3溶液中滴加HI溶液:Fe3++2I-===Fe2++I2 |
| B.向AlCl3溶液中加入过量的氨水:Al3++4NH3·H2O===AlO2-+4NH4++2H2O |
| C.向稀NH4HCO3溶液中加入过量NaOH溶液:NH4++OH-===NH3·H2O |
D.向苯酚钠溶液中通入少量CO2: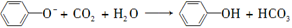 |
硼酸在玻璃制造和医药领域应用广泛。硼酸(H3BO3)溶液中存在如下电离过程:
H3BO3(aq)+H2O(l)  [B(OH)4] –(aq)+H+(aq) K=5.7×10–10(298K)。下列有关硼酸的说法不正确的是()
[B(OH)4] –(aq)+H+(aq) K=5.7×10–10(298K)。下列有关硼酸的说法不正确的是()
| A.25℃时0.7mol·L–1硼酸溶液中H+的浓度为2.0×10–5mol·L—1。 |
| B.硼酸与NaOH反应的离子方程式为H3BO3+OH–= [B(OH)4]–。 |
| C.碳酸钠溶液滴入硼酸中能观察到有气泡产生(已知碳酸的电离常数:K1=4.4×10—7、K2=4.7×10—11) |
| D.等物质的量浓度的Na[B(OH)4]溶液和CH3COONa溶液的pH:前者>后者(已知酸酸的电离常数K=1.75×10—5) |
现有下列短周期元素性质的数据:
 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
| 原子半径(nm) |
0.074 |
0.160 |
0.152 |
0.110 |
0.099 |
0.186 |
0.075 |
| 主要化合价 |
– 2 |
+2 |
+1 |
–3,+5 |
–1,+7 |
+1 |
–3,+5 |
下列说法中错误的是()
A.③与⑥、④与⑦处于同一主族
B.硫原子半径可能是0.10nm
C.元素②在周期表中的位置是第3周期IIA族
D.元素①、⑥形成的一种最稳定的化合物与水反应的离子方程式为Na2O+H2O=2Na++2OH-
常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通入少量CO2气体生成HX和NaHCO3;往NaY溶液中通入少量CO2生成HY和Na2CO3。下列有关叙述正确的是 ()
| A.酸性由强至弱:HX>HY>H2CO3 |
| B.结合H+的能力:Y->CO32->X->HCO3- |
| C.溶液碱性:NaX>Na2CO3>NaY>NaHCO3 |
| D.NaX溶液中通入足量CO2后的离子浓度: c(Na+)>c(HCO3-)>c(X-)>c(OH-)>c(H+) |
有关原电池的判断正确的是()
| A.比较活泼的金属一定做负极,活泼性较弱的金属一定做正极 |
| B.原电池的正、负极材料不一定都参与反应 |
| C.原电池的正极在放电后质量一定增加 |
| D.原电池的正极是电子流 |
下列与含硫化合物相关的说法正确的是
| A.浓硫酸有氧化性,稀硫酸没有氧化性 |
| B.SO3和SO2都是酸性氧化物,都能与少量Ca(OH)2反应生成难溶性沉淀 |
| C.BaSO4和BaSO3都是白色不溶于水沉淀,可通过加入稀硝酸是否溶解鉴别 |
| D.NaHSO4和NaHSO3都属于酸式盐,二者能够发生反应生成SO2 |