已知:将C12通入适量NaOH溶液,产物中可能有NaCl、NaClO、NaClO3,且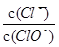 的值仅与温度高低有关。当n(NaOH)=6amol时,下列有关说法正确的是( )
的值仅与温度高低有关。当n(NaOH)=6amol时,下列有关说法正确的是( )
| A.改变温度,反应中转移电子的物质的量n的范围:3amol≤n≤5amol |
| B.改变温度,产物中NaCl的最小理论产量为4amol |
| C.参加反应的氯气的物质的量3amol |
D.某温度下,若反应后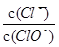 =6,则溶液中 =6,则溶液中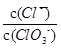 = =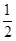 |
能正确表示下列反应的离子方程式是()
| A.浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑ |
| B.钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+ |
| C.NaHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑ |
| D.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ |
工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应如下:
①4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②2Na2CrO4+H2SO4Na2SO4+Na2Cr2O7+H2O
下列说法正确的是( )
| A.反应①和②均为氧化还原反应 |
| B.反应①的氧化剂是O2,还原剂是FeO·Cr2O3 |
| C.Na2Cr2O7中Cr元素的化合价为+7 |
| D.反应①中生成1 mol的Na2CrO4时共转移28 mol电子 |
向酸化过的MnSO4溶液中滴加(NH4)2S2O8(过二硫酸铵)溶液会发生反应:Mn2++S2O82-+H2O―→MnO4-+H++SO42-。下列说法不正确的是( )
| A.可以利用该反应检验Mn2+ |
| B.氧化性比较:S2O82->MnO4- |
| C.MnSO4溶液可以使用盐酸酸化 |
| D.若有0.1 mol氧化产物生成,则转移电子0.5 mol |
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下: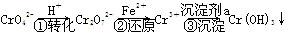
其中第①步中存在平衡:2CrO42- (黄色)+2H+Cr2O72- (橙色)+H2O。下列有关说法正确的是( )
| A.第①步当2v(Cr2O72-)=v(CrO42-)时,达到了平衡状态 |
| B.对于上述平衡,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO42-的生成 |
| C.第②步中,还原0.1 mol Cr2O72-需要45.6 g FeSO4 |
| D.第③步沉淀剂a可以使用NaOH等碱性物质 |
将一定量的Fe和Fe2O3的混合物放入250 mL、1.8 mol·L-1的HNO3溶液中,当固体混合物完全溶解后,在标准状况下生成1.12 L NO(HNO3的还原产物仅此一种),再向反应后的溶液中加入1.0 mol·L-1 NaOH溶液,若要使铁元素完全沉淀,所加入的NaOH溶液的体积最少应为( )
| A.300 mL | B.400 mL | C.450 mL | D.500 mL |