工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对生态系统造成很大的损害,其中还原沉淀法是常用的一种处理方法。流程如下: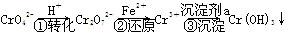
其中第①步中存在平衡:2CrO42- (黄色)+2H+Cr2O72- (橙色)+H2O。下列有关说法正确的是( )
| A.第①步当2v(Cr2O72-)=v(CrO42-)时,达到了平衡状态 |
| B.对于上述平衡,加入适量稀硫酸后,溶液颜色变黄色,则有利于CrO42-的生成 |
| C.第②步中,还原0.1 mol Cr2O72-需要45.6 g FeSO4 |
| D.第③步沉淀剂a可以使用NaOH等碱性物质 |
下列图示与对应的叙述不相符的是()
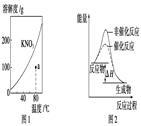

| A.图1表示KNO3的溶解度曲线,图中a点所示的溶液是80 ℃时KNO3的过饱和溶液 |
| B.图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
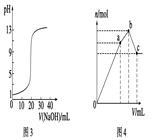
| C.图3表示0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1盐酸溶液得到的滴定曲线 |
| D.图4表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件可能是增大压强 |
如图,将纯Fe棒和石墨棒插入1 L饱和NaCl溶液中。下列说法正确的是( )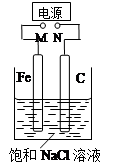
| A.M接负极,N接正极,当两极产生气体总量为22.4 L(标准状况)时,生成1 mol NaOH |
| B.M接负极,N接正极,在溶液中滴人酚酞试液,C电极周围溶液变红 |
| C.M接负极,N接正极,若把烧杯中溶液换成1 L CuSO4溶液,反应一段时间后,烧杯中产生蓝色沉淀 |
| D.M接电源正极,N接电源负极,将C电极换成Cu电极,电解质溶液换成CuSO4溶液,则可实现在铁上镀铜 |
下列说法正确的是( )
A.反应2Mg+CO2 2MgO+C ΔH<0从熵变角度看,可以自发进行 2MgO+C ΔH<0从熵变角度看,可以自发进行 |
B.在密闭容器发生可逆反应:2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小 N2(g)+2CO2(g) ΔH=-113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,ΔH变小 |
| C.已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,将等体积浓度为1.0×10-4mol/L的AgNO3溶液滴入到浓度均为1.0×10-4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生 |
| D.根据HClO的Ka=3.0×10-8,H2CO3的Ka1=4.3×10-7,Ka2=5.6×10-11,可推测相同状况下,等浓度的NaClO与Na2CO3溶液中,pH前者小于后者 |
下列溶液中微粒的物质的量浓度关系一定正确的是()
| A.0.2 mol/L CH3COONa溶液和0.1 mol/L HCl溶液等体积混合后,溶液显酸性: c(CH3COO-)>c(Na+)>c(Cl-)>c(H+)>c(OH-) |
| B.pH=3的盐酸和NaNO3的混合溶液中:c(Na+)=c(Cl-) |
| C.0.1 mol/L NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
| D.物质的量浓度相等的HCN(弱酸)和NaCN溶液等体积混合后有: |
c(HCN)+2c(H+)=2c(OH-)+c(CN-)
如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味的气体放出,符合这一情况的是( )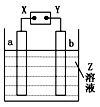
|   |
a极板 |
b极板 |
X电极 |
Z |
| A |
锌 |
石墨 |
负极 |
CuSO4 |
| B |
石墨 |
石墨 |
负极 |
NaOH |
| C |
银 |
铁 |
正极 |
AgNO3 |
| D |
铜 |
石墨 |
负极 |
CuCl2 |