三个化学小组的同学测定某Na2CO3固体样品(仅含NaOH杂质)的纯度,他们提出了各自的气体分析法。
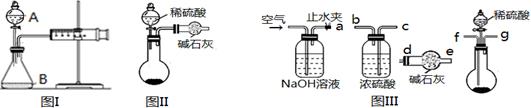
(1)第一小组用图I所示装置,仪器A的名称 。把m1 g的混合物与足量稀硫酸反应后,测定产生的CO2气体的体积。实验开始时需检查该装置气密性,具体的操作方法是 。
(2)第二小组用图II装置测定CO2的质量。该装置存在明显缺陷是 。
(3)第三小组在第二小组装置的基础上,解决了第二小组装置的问题。所用到的仪器如图III,装置的连接顺序是a— (填写接口字母,图中仪器可重复使用)。实验中取了样品m1 g,称量干燥管质量为m2 g,与足量稀硫酸反应后称量干燥管质量为m3 g,则Na2CO3的纯度表达式为 。
微型化学实验具有装置小巧,节约药品,操作简便,现象明显,安全可靠,减少污染等特点,下图是某同学设计的NH3的催化氧化并检验反应生成的酸性物质的微型装置(图中必要的铁架台、铁夹、微型酒精灯等均略去)。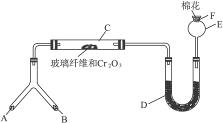
实验中所用试剂不超出下列范围:
①NH4Cl和Ca(OH)2的混合物②4∶1氨水③NaOH固体④KClO3和MnO2的混合物⑤蒸馏水⑥NH4HCO3固体⑦6 mol·L-1 NaOH溶液⑧0.5 mol·L-1 NaOH溶液⑨酚酞试液⑩碱石灰11浓H2SO412CuO
试完成下列问题:
(1)微型叉形管中液态物质A是__________,固体物质B是__________。
(2)C处发生反应的化学方程式是_______________________________________。
(3)混合物D是为了检验酸性物质的生成而放入的,其组成是__________,实验过程中的现象是_______________________。
(4)E处球形玻璃管的作用是________________________________________。
(5)F处的棉花应蘸取的物质是_________________________________,其反应的化学方程式是_____________________________________________________。
在进行研究性学习的过程中,学生发现等质量的铜片分别与等体积均过量的浓硝酸或稀硝酸反应,所得溶液(体积均相同)前者呈绿色,后者呈蓝色,针对这种现象,学生进行了讨论,出现两种意见:
一种认为Cu2+浓度差异引起了这种现象,你认为____________(填“正确”或“不正确”),依据是_______________________________________________________________________。
另一种意见是溶液呈绿色可能是Cu2+与NO2混合的结果,并用实验进行了证明,请简述实验方案与实验现象:_____________________________________________________________。
实验室常用饱和NaNO2与NH4Cl溶液反应制纯净氮气,反应式为:
NaNO2+NH4Cl====NaCl+2H2O+N2↑放热反应
实验装置如下图所示,试回答:
(1)装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是______(填写编号)。
a.防止NaNO2饱和溶液蒸发
b.保证实验装置不漏气
c.使NaNO2溶液容易滴下
(2)B部分的作用是________________。
a.冷凝
b.冷却氮气
c.缓冲氮气流
(3)加热前必须进行的一个操作步骤是___________________________________________;加热片刻后,即应移去酒精灯以防反应物冲出,其原因是____________________________。
(4)收集N2前,必须进行的步骤是(用文字说明)__________________________________。收集N2最适宜的方法是(填写编号)_________________。
a.用排气法收集在集气瓶中
b.用排水法收集在集气瓶中
c.直接收集在球胆或塑料袋中
某研究性学习小组的一个课题是“NO2能否支持木条的燃烧?”由于实验室中没有现成的NO2气体,该小组的同学设计了两个方案(忽略N2O4的存在,图中铁架台等夹持仪器均已略去):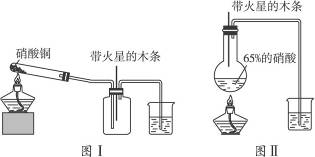
Ⅰ.实验装置如图Ⅰ所示
(1)硝酸铜固体加热分解的产物有氧化铜、二氧化碳和氧气。写出该反应的化学方程式:___________________________。
(2)当集气瓶中充满红棕色气体时,木条复燃了,有的同学得出“NO2能支持木条的燃烧”的结论。你认为这一结论是否正确?_______(填“正确”或“不正确”),理由是___________________。
Ⅱ.实验装置如图Ⅱ所示
(1)写出浓硝酸受热分解的化学方程式:__________________________。
(2)实验开始后木条上的火星逐渐熄灭,有的同学提出“NO2不能支持木条的燃烧”的结论。你认为这一结论是否正确?________(填“正确”或“不正确”),理由是______________________。
Ⅲ.为了更能直接说明“NO2能否支持木条的燃烧”这一问题,请你重新设计一个简单的实验方案,简述实验原理和主要操作。
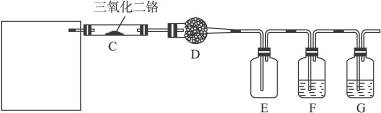
硝酸是一种重要的化工原料,工业上通常采用氨氧化法制取。某校化学兴趣小组的同学以氯化铵和氢氧化钙为主要原料并设计了下列装置来制硝酸(三氧化二铬为催化剂,加热及夹持装置未画出):
完成下列问题:
(1)实验时,A、C两装置均需加热,应先加热_________装置,原因是______________________。
(2)D装置中应填充的物质是_________,该物质的主要作用是__________________________。
(3)E装置的作用是__________________,F、G装置中的物质分别是____________________。
(4)若保留上图中黑色粗线框内的装置,但去掉通空气的导管B,将C装置中的双孔橡皮塞换成单孔橡皮塞,请你用图示的方法设计一个最简单的实验方案同样完成硝酸的制取(在下面的方框中画出装置图并注明所用药品的名称)。