化学实验离不开水。请根据水的不同作用和功能,分析以下四个装置图,回答问题:

实验一:制取氢气
(1)图甲所示装置可用于实验室制取氢气,这种制气装置在加入反应物前,如何检查气密性 。
(2)用锌与稀硫酸制取氢气时,加入少量硫酸铜溶液会加快产生氢气的速率,请解释加快反应速率的原因: 。
实验二:喷泉实验
(3)图乙所示装置中烧瓶已装满干燥氨气, 进行喷泉实验时应该先___________(填“挤捏胶头滴管”或“打开止水夹”)。
(4)如果只提供如图丙所示装置,若想迅速引发喷泉,下列方法可行的是 。
a.用热毛巾捂住烧瓶
b.用冰块捂住烧瓶
c.将烧杯中的水换成饱和食盐水
d.向烧杯中加入少量硫酸
实验三:探究一定温度下能使铁钝化的硝酸的最低浓度,实验装置如图丁所示。
①开始实验时,观察到灵敏电流计指针指向铜丝,但又迅速反转指向铁丝;
②再用盛蒸馏水的注射器缓慢向具支试管内加水并振荡,在指针恰好开始反转指向铜丝时停止实验;
③重复三次实验得平均加水量为2.5 mL(水的密度按1.0g/mL计算)。
(5)该实验装置的不足之处是__________________________。
(6)当指针第一次指向铜丝时,正极的电极反应式为 。
(7)根据此实验计算,使铁钝化的硝酸最低质量分数为 。
Ⅰ.铁是人体必需的微量元素,绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。
(1)FeSO4溶液在空气中会因氧化变质产生红褐色沉淀,其发生反应的离子方程式是;实验室在配制FeSO4溶液时常加入以防止其被氧化。请你设计一个实验证明FeSO4溶液是否被氧化。
Ⅱ.硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,常用于代替硫酸亚铁。
(2)硫酸亚铁铵不易被氧化的原因是。
(3)为检验分解产物的成分,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。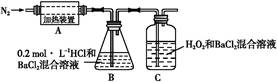
①A中固体充分加热较长时间后,通入氮气,目的是。
②装置B中BaCl2溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,观察到的现象为。
③实验中,观察到C中有白色沉淀生成,则C中发生的反应为(用离子方程式表示)。
草酸亚铁(FeC2O4·2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。已知:CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉。回答下列问题:
Ⅰ:兴趣小组对草酸亚铁的分解产物进行实验和探究。
(1)将气体产物依次通过A、澄清石灰水,B、氯化钯,观察到A中澄清石灰水变浑浊,B中有黑色物质生成,则上述现象说明气体产物中有。
(2)探究分解得到的固体产物中铁元素的存在形式。
①提出假设
假设1:; 假设2:FeO; 假设3:FeO和Fe的混合物。
②设计实验方案证明假设3。
限选试剂:1.0 mol·L-1盐酸、3% H2O2溶液、0.1 mol·L-1CuSO4溶液、20% KSCN溶液、蒸馏水。
| 实验步骤 |
现象与结论 |
| 步骤1:向试管中加入少量固体产物,再加入足量,充分振荡 |
若溶液颜色明显改变,且有生成,则证明有铁单质存在 |
| 步骤2:将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 |
|
| 步骤3:取步骤2得到的少量固体于试管中,滴加 |
Ⅱ:某草酸亚铁样品中含有少量草酸。现用滴定法测定该样品中FeC2O4的含量。滴定反应是:5Fe2+ +5C2 +3Mn
+3Mn +24H+
+24H+ 5Fe3+ +10CO2↑+3Mn2++12H2O实验方案设计为:
5Fe3+ +10CO2↑+3Mn2++12H2O实验方案设计为:
①将准确称量的0.20 g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70 ℃左右,立即用浓度为0.020 00 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为V1 mL。
②向上述滴定混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5~8 min,用KSCN溶液在点滴板上检验点滴液,直至溶液不立刻变红。将滤液过滤至另一个锥形瓶中,继续用0.020 00 mol/L的高锰酸钾标准溶液滴定至终点,记下滴定管内液面读数为V2 mL。
③重复以上实验1~2次。
若某小组的一次测定数据记录如下:V1=" 18.90" mL,V2="6.20" mL。根据数据计算0.20 g样品中:n(Fe2+)=; n(C2 )=;FeC2O4的质量分数为(精确到0.01%)。
)=;FeC2O4的质量分数为(精确到0.01%)。
某小组同学将一定浓度NaHCO3溶液加入到CuSO4溶液中发现生成了沉淀。甲同学认为沉淀是CuCO3;乙同学认为沉淀是CuCO3和Cu(OH)2的混合物,他们设计实验测定沉淀中CuCO3的质量分数。
(1)按照甲同学的观点,发生反应的离子方程式为。
(2)两同学利用下图所示装置进行测定: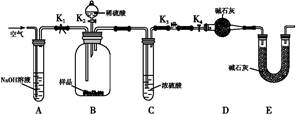
①在研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为过滤、洗涤、干燥。
②装置E中碱石灰的作用是。
③实验过程中有以下操作步骤:
a.关闭K1、K3,打开K2、K4,充分反应
b.打开K1、K4,关闭K2、K3,通入过量空气
c.打开K1、K3,关闭K2、K4,通入过量空气
正确的顺序是(填选项序号,下同)。若未进行步骤,将使测量结果偏低。
④若沉淀样品质量为m g,装置D质量增加了n g,则沉淀中CuCO3的质量分数为。
(3)丙同学认为还可以通过测量CO2的体积并测量来测定沉淀中CuCO3的质量分数。
某学习兴趣小组探究氨气的制取实验:
(1)甲同学拟用下列实验方法制备氨气,其中合理的是(填序号,下同)。
| A.将氯化铵固体加热分解 |
| B.将浓氨水滴入氢氧化钠固体中 |
| C.将氢氧化钠固体加入浓氨水中 |
| D.将氯化铵稀溶液滴入氢氧化钠固体中 |
(2)如图是甲同学设计收集氨气的几种装置,其中可行的是,集气的原理是。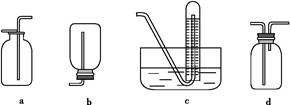
某化学探究小组欲对SO2的化学性质进行如下探究,请你帮助他完成实验报告。
| 物质 |
类别 |
化学性 质预测 |
实验验证 |
||
| 实验操作 |
实验现象 |
实质(用离子 方程式表示) |
|||
| 二氧 化硫 |
酸性 氧化物 |
与水 反应 |
将盛满SO2气体的试管倒立在水中,并测定试管中溶液的pH |
① |
SO2+H2O H2SO3 H2SO3 |
| 与碱 反应 |
② |
出现白 色沉淀 |
③ |
(2)该探究小组还根据SO2中S元素的化合价,预测并通过实验探究SO2的其他性质。探究过程中选用的实验药品有:浓硫酸、亚硫酸钠固体、Na2S溶液、酸性高锰酸钾溶液、品红溶液等。探究过程的实验装置图如图所示,请回答下列问题。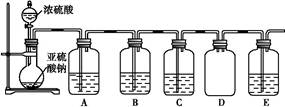
①请你完成下列表格。
| 装置 |
药品 |
作用 |
| A |
验证二氧化硫的还原性 |
|
| B |
||
| C |
品红溶液 |
②A中发生反应的离子方程式为。
③实验时C中的实验现象是。
④D装置的作用是。E是尾气处理装置,有人认为E装置中可以加入足量的Ba(NO3)2溶液,你认为是否合理,请结合离子方程式加以说明:。