二氧化碳的捕集、利用与封存(CCUS)是我国能源领域的一个重要战略方向,CCUS或许发展成一项重要的新兴产业。
(1)已知:CH4(g) + 2O2(g)=CO2(g) + 2H2O(g) ΔH1= a kJ•mol-1
CO(g) + H2O (g)=CO2(g) + H2(g) ΔH2= b kJ•mol-1
2CO(g) + O2(g)=2CO2(g) ΔH3 = c kJ•mol-1
反应CO2(g) + CH4(g) = 2CO(g) + 2H2(g) 的ΔH= kJ•mol-1。
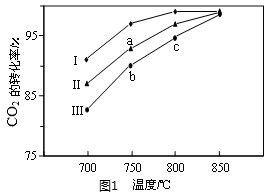
(2)利用废气中的CO2为原料制取甲醇,反应方程式为:CO2+3H2  CH3OH+H2O其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图1所示。
CH3OH+H2O其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图1所示。
①a点所代表的状态________(填“是”或“不是”)平衡状态。
②c点CO2的转化率高于b点,原因是_____________________________________。
(3)在实际生产中发现,随着甲醇的生成,还伴随有少量CO副产物出现:
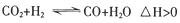 ,且CO2的转化率、甲醇的产率和CO含量除受浓度、度、压强等因素影响外,还受催化剂CuO的质量分数、气体混合物在反应锅炉内的流动速率影响(用空间流率表示)。通过实验分别得到如下数据图2、3:
,且CO2的转化率、甲醇的产率和CO含量除受浓度、度、压强等因素影响外,还受催化剂CuO的质量分数、气体混合物在反应锅炉内的流动速率影响(用空间流率表示)。通过实验分别得到如下数据图2、3:
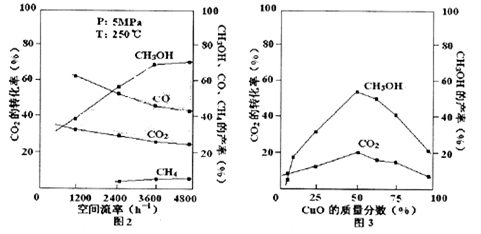
①由图2得,最佳空间流率为 h-1。
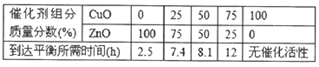
②在其他条件不变的前提下调整催化剂配比,并记录到达平衡所需的时间,得到如下表数据,试说明不选择单组份ZnO原因是 。
(4)用二氧化碳催化加氢来合成低碳烯烃,起始时以0.1MPa,n(H2):n(CO2)=3:1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g)  C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图4所示:
C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图4所示:

①该进行的反应的△S 0(填:“>”或“<”)。
②对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则该反应的KP= 。
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是 (列举2项)。
碘及其化合物在人类活动中占有重要地位。
(1)加碘食盐中含有碘酸钾(KIO3),工业上以电解法制备碘酸钾,电解设备如图所示。先将一定量的碘溶于过量氢氧化钾溶液,发生反应: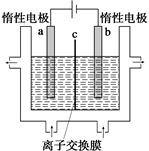
3I2+6KOH=5KI+KIO3+3H2O,再将该溶液加入(阴极、阳极)区,另将氢氧化钾溶液加入另外一个区。使用(阴、阳)离子交换膜,在阳极发生的电极反应式:。
(2)碘化氢不稳定,分解反应的热化学方程式是2HI(g)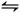 I2(g)+H2(g) ΔH="+9.48" kJ·mol-1已知ΔS>0
I2(g)+H2(g) ΔH="+9.48" kJ·mol-1已知ΔS>0
①该反应属于( )
A.任何温度均自发 B.任何温度均不自发 C.高温自发 D.低温自发
②一定条件下,反应在一个带有活塞的密闭容器中达到平衡,下列说法中不正确的是( )
A.恒温,缩小体积,平衡常数不变
B.恒温,缩小体积,平衡不移动,颜色加深
C.恒容,升温,正向反应速率和逆向反应速率均增大
D.恒容,在容器中若投入2mol HI,达到平衡时吸收9.48 kJ 的热量
③一定温度下,平衡常数K=1/4,在2L的容器中,加入4molHI发生反应达到平衡,HI的转化率。
在温度为298K时,将0.10 mol无色的N2O4气体放入1L抽空的密闭容器中,出现红棕色,直至建立N2O4(g) 2NO2(g)的平衡。下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间)。
2NO2(g)的平衡。下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间)。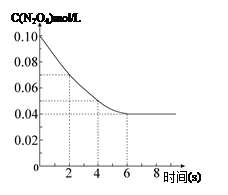
|
(1)计算在2s至4s时间内,NO2的平均生成速率为 。
(2)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到同样的平衡状态,二氧化氮的起始浓度是 mol·L-1。| T/K |
310 |
320 |
| K值 |
0.38 |
0.42 |
据此判断该反应正反应是 反应(填“吸热”或“放热”)
(6)若其他条件不变,反应在398K条件下进行并达到平衡,此温度下N2O4的浓度随时间变化的曲线(以298K条件下进行并达到平衡的曲线作为参照)正确的是 ( )
(1)家用液化石油气的主要成分之一是丁烷(C4H10),当10 kg丁烷完全燃烧并生成二氧化碳气体和液态水时,放出的热量为5×105 kJ。试写出丁烷燃烧的热化学方程式:。已知1mol液态水汽化时需要吸收44 kJ热量,则反应C4H10(g)+6.5O2(g)=4CO2(g)+5H2O(g)的ΔH=。
(2)有同学用丁烷与空气为原料制作一燃烧电池,通入丁烷的一极为极。若以稀硫酸为电解质溶液时,其正极反应式为。
(3)已知:Fe(s) +1/2O2(g)=FeO(s)ΔH=-272.0kJ·mol-1
2Al(s)+3/2O2(g)=Al2O3(s) ΔH=-1675.7kJ·mol-1
Al和FeO发生铝热反应的热化学方程式是。
(4)已知拆开1 mol H-H键,1 molN-H键,1 molN≡N键分别需要的能量是akJ、bkJ、ckJ,则N2与H2反应生成NH3的热化学方程式为。
生态农业涉及农家肥料的综合利用,某种肥料经发酵得到一种含甲烷、CO2、氮气的混合气体2.016升(标准状况),该气体通过盛有红热CuO粉末的硬质玻璃管,发生反应:CH4+4CuO CO2+2H2O+4Cu。当CH4完全反应后,硬质玻璃管的质量减轻4.8克。将该反应后产生的气体通过过量澄清石灰水中,充分吸收,生成沉淀8.5克。
CO2+2H2O+4Cu。当CH4完全反应后,硬质玻璃管的质量减轻4.8克。将该反应后产生的气体通过过量澄清石灰水中,充分吸收,生成沉淀8.5克。
(1)原混合气体中CH4的物质的量为________mol;
(2)原混合气体中N2的体积分数为________。
明矾具有抗菌、收敛等作用,可作中药及净水剂等,4.74g的明矾晶体[KAl(SO4)2·12H2O]受热脱水的过程中的热重曲线m~n(样品的质量随温度变化的曲线)如下。
请回答下列问题:
(1)试确定70℃时固体物质的化学式____________________ (要求写出推断过程)。
(2)写出200℃时发生反应的化学方程式______________________________。
(3)在770℃时充分灼烧,最后得到固体产物A及气体B,B能全部溶解在BaCl2溶液中并形成白色沉淀;A可部分溶于水,过滤后得到固体C和滤液D,向D中加入BaCl2溶液也能得到白色沉淀,将C置于适量的NaOH溶液中恰好反应得到澄清的溶液E。则n中固体成分是的_________,质量分别为__________B的化学式为________。