(1)某学生欲用11.9 mol·L-1的浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol·L-1的稀盐酸。该学生需要量取______________mL浓盐酸进行配制。(保留小数点后1位)
(2)容量瓶是配制溶液的必需仪器。下列关于容量瓶及其使用方法的叙述,错误的是
①是配制一定物质的量浓度的溶液的专用仪器
②使用前要先检查容量瓶是否漏液
③容量瓶可以用来加热
④不能用容量瓶长期贮存配制好的溶液
⑤可以用500mL容量瓶配制250mL溶液
⑥容量瓶上标有的是温度 、容量 、刻度线
a.① ③ b.① ④ c.③ ⑤ d.⑤ ⑥
(3)①该同学用配制的0.400 mol·L-1的盐酸,中和含0.4 g NaOH的NaOH溶液,则该同学需取___________mL盐酸。
②假设该同学用新配制的盐酸中和含0.4 g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是_________________。
a.浓盐酸挥发,浓度不足
b.配制溶液时,未洗涤烧杯
c.配制溶液时,俯视容量瓶刻度线
d.加水时超过刻度线,用胶头滴管吸出
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为____________________________。利用反应6NO2+8NH3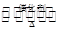 7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是________L。
7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是________L。
(2)已知:2SO2(g)+O2(g)  2SO3(g) ΔH="—196.6" kJ/mol ;
2SO3(g) ΔH="—196.6" kJ/mol ;
2NO(g)+O2(g)  2NO2(g)ΔH="—113.0" kJ/mol ;
2NO2(g)ΔH="—113.0" kJ/mol ;
①则反应NO2(g)+SO2(g)  SO3(g)+NO(g) 的ΔH=________ kJ/mol。
SO3(g)+NO(g) 的ΔH=________ kJ/mol。
②一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
| A.体系压强保持不变 |
| B.混合气体颜色保持不变 |
| C.SO3和NO的体积比保持不变 |
| D.每消耗1 mol SO3的同时生成1 mol NO2 |
③测得上述反应平衡时NO2与SO2的体积比为1∶6,则平衡常数K=___。
(3)催化剂存在下,NH3可用来消除NO的污染,生成两种对环境无害的物质。写出反应的化学方程式:;该反应中氧化产物与还原产物的物质的量之比为。
(4)氯碱工业的原料饱和食盐水中含有一定量的铵根离子,在电解时会生成性质极不稳定的三氯化氮,易引起爆炸。为除去饱和食盐水中的铵根离子,可在碱性条件下通入氯气,反应生成氮气。该反应的离子方程式为。
(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈(填“酸性”、“中性”或“碱性”,下同),溶液中c(Na+)c(CH3COO-)(填“>”、“=”或“<”)。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈,溶液中c(Na+)c(CH3COO-)。
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈,醋酸体积氢氧化钠溶液体积。
(4)将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+)氢氧化钠溶液中c(OH-),m与n的大小关系是mn。
(5)pH相同的氨水和氢氧化钠溶液,分别用蒸馏水稀释至原来体积的m倍和n倍,稀释后两溶液的pH仍相同,则m________n(填“>”、“<”或“=”);
(选考)【化学——选修5:有机化学基础】化合物H可用以下路线合成: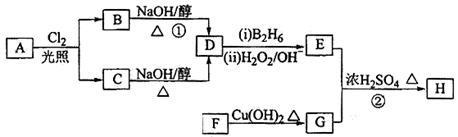
已知: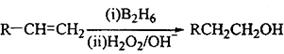
回答下列问题:
(1)11.2L(标准状况)的烃A在氧气中充分燃烧可以生成88gCO2和45gH2O,且A分子结构中有3个甲基,则A的结构简式为;
(2)B和C均为一氯代烃,D的名称(系统命名)为;
(3)在催化剂存在下1molF与2molH2反应,生成3—苯基—1—丙醇。F的结构简式__
(4)反应①的反应类型是;
(5)反应②的化学方程式为;
(6)写出所有与G具有相同官能团的芳香类同分异构体的结构简式。
(选考)【化学——物质结构与性质】
太阳能电池常用材料除单晶硅,还有铜铟镓硒等化合物。
(1)镓的基态原子的电子排布式是。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为(用元素符号表示)________。
(3)气态SeO3分子的立体构型为________。
(4)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是:_________________________________。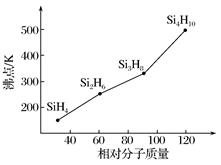
(5)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质,则[B(OH)4]-中B的 原子杂化类型为;
(6)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子方程式为;
(7)一种铜金合金晶体具有面心立方最密堆积的结构。在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为_____________,若该晶胞的边长为a pm,则合金的密度为______________________ g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
(选考)【化学——选修2:化学与技术】)
(1)粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO2-4等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号)
(2)工业生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。选择适宜的催化剂,是否可以提高SO2的转化率?(填“是”或“否”),是否可以增大该反应所放出的热量?(填“是”或“否”);
(3)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦碳在高温的氮气流中,通过以下反应制得:SiO2+ C + N2 =Si3N4 + CO)
①配平上述反应的化学方程式__________
②该反应的平衡常数表达式为K=__________
(4)水是一种重要的自然资源,天然水在净化处理过程中加入的混凝剂可以是__(填两种物质名称),其净水作用的原理是__________