根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题:
(1)该反应中氧化剂是 ,被氧化的是 元素。
(2)用双线桥法标出电子转移的方向与数目。
(3)该反应中参加氧化还原的氧化剂与还原剂的物质的量之比为 。
某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图。加热聚丙烯废塑料得到的产物如下表:
| 产物 |
氢气 |
甲烷 |
乙烯 |
丙烯 |
苯 |
甲苯 |
碳 |
| 质量分数(%) |
12 |
24 |
12 |
16 |
20 |
10 |
6 |
(1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔。
A中残留物 电石
电石 乙炔
乙炔 聚乙炔
聚乙炔
写出反应②和③的化学方程式:②______________________________;
③______________________________;
(2)试管B收集到的产品中,能使酸性高锰酸钾溶液褪色的物质,其一氯代物的结构简式分别是
______________________________________________________。
(3)锥形瓶C中观察到的现象:______________________________。
(4)写出C中逸出的气体在工业上的两种用途__________、__________。
已知某种燃料含有碳、氢、氧三种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过图示装置,得到如表所列的实验数据(产生的气体完全被吸收)。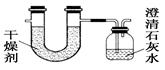
| 实验前 |
实验后 |
|
| (干燥剂+U形管)的质量 |
101.1g |
102.9g |
| (澄清石灰水+广口瓶)的质量 |
312.0g |
314.2g |
根据实验数据填空:
(1)实验完毕后,生成物中水的质量为____g,假设广口瓶里生成一种正盐,其质量为______g。
(2)生成的水中氢元素的质量为________g。
(3)生成的CO2中碳元素的质量为________g。
(4)该燃料中碳、氢元素质量比为________.
A~G是几种烃的分子球棍模型,据此回答下列问题:
(1)常温下含碳量最高的气态烃是________(填对应字母);
(2)能够发生加成反应的烃有________(填数字)种;
(3)一卤代物种类最多的是________(填对应字母);
有机化学中的反应类型较多,将下列反应归类(填序号)。
①由乙炔制氯乙烯
②乙烷在空气中燃烧
③乙烯使溴的四氯化碳溶液褪色
④乙烯使酸性高锰酸钾溶液褪色
⑤由乙烯制聚乙烯
⑥甲烷与氯气在光照的条件下反应
⑦甲苯制三硝基甲苯
其中属于取代反应的是______;属于氧化反应的是_______;属于加成反应的是__________;属于聚合反应的是__________
(1)按系统命名法命名. :_________
:_________
(CH3)2CH(CH2)2CH(C2H5)CH=CH2:_________
(2)写出支链只有一个乙基且相对分子质量最小的烷烃结构简式_________