设阿伏加德常数为NA.则下列说法正确的是( )
| A.标准状况下,2.24L乙醇中含有氧原子数为0.1NA |
| B.标准状况下,0.3mol二氧化硫中含有氧原子数为0.3NA |
| C.常温下,5.6gFe与硝酸反应,失去的电子数一定为0.3NA |
| D.常温常压下,8g甲烷中含有的极性共价键为2NA |
将一小块钠投入下列溶液时,既能产生气体又会出现白色沉淀的是
| A.稀H2SO4 | B.硫酸铜溶液 | C.氢氧化钠溶液 | D.氯化镁溶液 |
某粒子用符号 M
M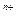 表示,下列关于该粒子的叙述中,正确的是
表示,下列关于该粒子的叙述中,正确的是
| A.所含质子数为(A-n) | B.所含中子数为(A-Z-n) |
| C.所含电子数为(Z+n) | D.中子数-电子数=A-2Z+n |
只含有一种元素的物质不可能是
| A.混合物 | B.化合物 | C.纯净物 | D.单质 |
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为()
| A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。 |
| B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。 |
| C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。 |
| D.氨气分子是极性分子而甲烷是非极性分子。 |
有关杂化轨道的说法不正确的是()
| A.杂化前后的轨道数不变,但轨道的形状发生了改变 |
| B.sp3、sp2、sp杂化轨道的夹角分别为109°28′、120°、180° |
| C.四面体形、三角锥形、V形分子的结构可以用sp3杂化轨道解释 |
| D.杂化轨道全部参加形成化学键 |