提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是( )
| |
被提纯的物质 |
除杂试剂 |
分离方法 |
| A |
乙酸乙酯(乙酸) |
CCl4 |
萃取、分液 |
| B |
乙烷(乙烯) |
酸性KMnO4溶液 |
洗气 |
| C |
溴苯(溴) |
氢氧化钠溶液 |
分液 |
| D |
苯(苯酚) |
浓溴水 |
过滤 |
下列图示的四种实验操作对应描述正确的是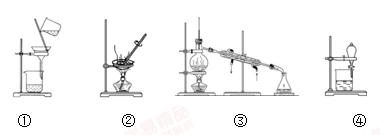
| A.除去KCl溶液中的K2CO3,加入适量Ca(NO3)2溶液,再用①装置分离 |
| B.用②装置除去自来水中的Cl-等杂质 |
| C.回收碘的CCl4溶液中的CCl4,可选用③装置 |
| D.分离水和植物油,选用④装置,下层的植物油可从分液漏斗的下层放出 |
有下列物质,正盐:钾盐、钠盐、铵盐、钡盐,酸:盐酸、硝酸、醋酸、稀硫酸,在水溶液中符合离子方程式:2H++CO32-═CO2↑+H2O的化学反应的组合共有
| A.6个 | B.9个 | C.12个 | D.15个 |
已知单位体积的溶液中,难挥发性溶质的分子或离子数越多,该溶液的沸点越高,则下列溶液的沸点最高的是
| A.2L 0.01mol/L的蔗糖溶液 |
| B.2L 0.01mol/L的CaCl2溶液 |
| C.1L 0.02mol/L的NaCl溶液 |
| D.1L 0.02mol/L的CH3COOH溶液 |
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图,下列说法正确的是
| A.反应消耗镁、铝的物质的量之比是3:2 |
| B.反应消耗镁、铝的质量之比是3:2 |
| C.与镁和铝反应的硫酸的物质的量之比是3:2 |
| D.与镁和铝反应的硫酸的质量之比是3:2 |
设NA为阿伏加德罗常数的值,下列说法正确的是
| A.6.8g液态KHSO4中含有0.1NA个阳离子 |
| B.NA个Fe(OH)3胶体粒子形成的纳米材料的质量为107g |
| C.等体积等密度的N2和CO所含分子数相同 |
| D.含NA个Na+的Na2O溶解于水1L水中,Na+的物质的量浓度为1mol•L-1 |