有效碰撞是指( )
| A.反应物分子间的碰撞 |
| B.反应物活化分子间的碰撞 |
| C.能发生化学反应的碰撞 |
| D.反应物活化分子间有合适取向的碰撞 |
现有三组混合液:①乙酸乙酯和碳酸钠溶液;②乙醇和丁醇;③溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
| A.分液、萃取、蒸馏 | B.萃取、蒸馏、分液 |
| C.分液、蒸馏、萃取 | D.蒸馏、萃取、分液 |
下列各有机物的分类或命名正确的是()
A.对甲基苯酚(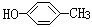 )属于芳香烃 )属于芳香烃 |
B.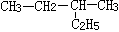 2-乙基丁烷 2-乙基丁烷 |
C. 3-丁醇 3-丁醇 |
D. 3-甲基-1-丁烯 3-甲基-1-丁烯 |
某烯烃A,分子式为C8H16,A在一定条件下被氧化只生成一种物质B。已知:
则符合上述条件的烃A有()种(考虑顺反异构)。
A.6 B.8 C.4 D.5
“绿色化学”是当今社会提出的一个新概念。在“绿色化学工艺中,理想状态是反应物中原子全部转化为欲制的产物,即原子的利用率为100%。在用丙炔合成甲基丙烯酸甲酯( )的过程中,欲使原子利用率达到最高,还需要其他的反应物是( )
)的过程中,欲使原子利用率达到最高,还需要其他的反应物是( )
| A.CO和CH3OH | B.CO2和H2O | C.H2和CO2 | D.CH3OH和H2 |
八角茴香含有一种抗禽流感病毒的重要成分——莽草酸,其分子结构如图。下列关于莽草酸的说法错误的是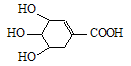
| A.分子式为C7H10O5 | B.遇FeCl3溶液呈紫色 |
| C.能使溴水褪色 | D.能溶于水 |