某温度下,水的离子积Kw=l×10-13。有酸溶液A,pH=a;碱溶液B,pH=b。为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置。
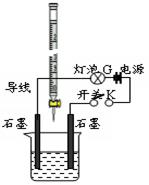
(1)实验时,烧杯中应盛 (选A或B)溶液。
(2)若A为一元强酸,B为一元强碱,且a+b=13。该同学在烧杯中先加入其中一种溶液,闭合开关K,测得烧杯中灯泡的亮度为10(假设亮度由暗到亮表示为1、2、3、…10、11、12、… 20)。断开开关K,将滴定管中的溶液逐滴加入到烧杯中。当从滴定管滴入烧杯中的溶液体积和烧杯中盛有的溶液体积相等时,停止滴加溶液并闭合开关K,此时灯泡G的亮度约为 ,原因是 。烧杯中得到的溶液pH= 。
(3)若A为强酸,B为强碱,且a+b=13。断开开关K,将滴定管中的溶液逐滴加入到烧杯中。当测得烧杯中溶液pH和“⑵”中最后得到的溶液pH相同时,停止滴加溶液。此时烧杯中的溶液中阳离子浓度大于阴离子浓度,原因可能是 。
(4)若A的化学式为HR,B的化学式为MOH,且a+b=13,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为 。
此时烧杯中的混合溶液中,微粒浓度大小关系一定正确的是 (填序号)。
①c(MOH)>c(M+)>C(R-)>c(H+)>c(OH-)
②c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
③c(R-)>c(M+)>c(H+)>c(OH-)
④c(M+)>c(R-)>c(OH-)>c(H+)
⑤c(M+)+ c(H+)=c(R-)+c(OH-)
⑥c(MOH)=c(H+)-c(OH-)
工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为
)发生反应:
 。某课题组用
为原料模拟该过程,探究上述反应的实验条件及固体产物的成分。
。某课题组用
为原料模拟该过程,探究上述反应的实验条件及固体产物的成分。
(1)上述反应的平衡常数表达式:
。
(2)室温时,向两份相同的样品中分别加入同体积、同浓度的
和
溶液均可实现上述转化,在溶液中
转化率较大,理由是。
(3)查阅文献:上述反应还可能生成碱式碳酸铅[
],它和
受热都易分解生成
。该课题组对固体产物(不考虑
)的成分提出如下假设,请你完成假设二和假设三:
假设一:全部为
;
假设二:;
假设三:。
(4)为验证假设一是否成立,课题组进行如下研究。
①定性研究:请你完成下表中内容。
| 实验步骤(不要求写出具体操作过程) |
预期的实验现象和结论 |
| 取一定量样品充分干燥,…… |
②定量研究:取26.7 的干燥样品,加热,测的固体质量随温度的变化关系如下图。某同学由图中信息得出结论:假设一不成立。你是否同意该同学的结论,并简述理由:
。
亚硫酸盐是一种常见食品添加剂。为检验某食品中亚硫酸盐含量(通常
样品中含
的质量计),某研究小组设计了如下两种实验流程:
(1)气体
的主要成分是,为防止煮沸时发生暴沸,必须先向烧瓶中加入;通入N2的目的是。
(2)写出甲方案第①步反应的离子方程式:。
(3)甲方案第②步滴定前,滴定管需用
标准溶液润洗,其操作方法是。
(4)若用盐酸代替稀硫酸处理样品,则按乙方案实验测定的结果(填"偏高"、"偏低"或"无影响")
(5)若取样品
,按乙方案测得消耗0.01000
溶液
,则1
样品中含
的质量是g(用含
的代数式表示)。
实验室常用
与浓盐酸反应制备
(发生装置如图所示)。
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是(填序号)
A.往烧瓶中加人
粉末
B.加热
C.往烧瓶中加人浓盐酸
(2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
甲方案:与足量
溶液反应,称量生成的
质量。
乙方案:采用酸碱中和滴定法测定。
丙方案:与已知量
(过量)反应,称量剩余的
质量。
丁方案:与足量
反应,测量生成的
体积。
继而进行下列判断和实验:
① 判定甲方案不可行,理由是。
② 进行乙方案实验:准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00
,用0.1000
标准溶液滴定,消耗22.00
,该次滴定测得试样中盐酸浓度为
b.平行滴定后获得实验结果。
③ 判断丙方案的实验结果(填"偏大"、"偏小"或"准确")。
) = 2.8×10-9、
= 2.3×10-11
④ 进行丁方案实验:装置如图所示(夹持器具已略去)。
(i) 使Y形管中的残余清液与锌粒反应的正确操作是将转移到中。
(ii)反应完毕,每间隔1 分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是(排除仪器和实验操作的影响因素)。
甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计如下实验流程:
实验中,先用制的的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完毕后,黑色的氧化铜转化为红色的铜。
下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。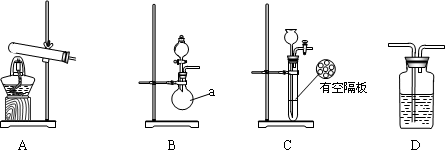
甲小组测得,反应前氧化铜的质量
、氧化铜反应后剩余固体的质量
、生成氮气在标准状况下的体积
。
乙小组测得,洗气前装置D的质量
、洗气后装置D的质量
、生成氨气在标准状况下的体积
。
请回答下列问题:
(1)写出仪器a的名称。
(2)检查A装置气密性的操作是。
(3)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填写在下表的空格中。
| 实验装置 |
实验药品 |
制备原理 |
|
| 甲小组 |
A |
氢氧化钙、硫酸、硫酸铵 |
反应的化学方程式为。 |
| 乙小组 |
浓氨水、氢氧化钠 |
用化学平衡原理分析氢氧化钠的作用:。 |
(4)甲小组用所测得数据计算出氨分子中氮、氢的原子个数之比为。
(5)乙小组用所测得数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是
。为此,乙小组在原有实验的基础上增加了一个装有某药品的实验仪器,重新实验。根据实验前后该药品的质量变化及生成氨气的体积,得出了合理的实验结果。该药品的名称是。
某课外活动小组对甲酸进行了如下的实验,以验证其含有醛基,并考察其化学性质,首先做了银镜反应.
(1)在甲酸进行银镜反应前,必须在其中加入一定量的,因为;
(2)写出甲酸进行银镜反应的化学方程式:
(3)某同学很成功的做了银镜反应,他肯定没有进行的操作________(写字母):
| A.用洁净的试管; |
| B.在浓度为2%的NH3·H2O中滴入稍过量的浓度为2%的硝酸银; |
| C.用前几天配制好的银氨溶液; |
| D.在银氨溶液里加入稍过量的甲酸; |
E、用小火对试管直接加热;
F、反应过程中,振荡试管使之充分反应.
然后,同学们对甲酸与甲醇进行了酯化反应的研究:
(4)乙装置中长导管A的作用是;
(5)写出甲酸和甲醇进行酯化反应的化学方程式
(6)选择甲装置还是乙装置好?________,原因是;
(7)实验过程中选用的药品及试剂有:浓H2SO4、甲醇、甲酸还有________、________两种必备用品.
(8)一同学用装有饱和氢氧化钠的三颈瓶接收甲酸甲酯,几乎没有收集到产物,
请给予合理的解释。