可逆反应2A(s)+3B(g) C(g)+2D(g)ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
C(g)+2D(g)ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
| A.①② | B.④ | C.③ | D.④⑤ |
采取以下措施,一定会使化学平衡发生移动的是( )
| A.加入一种反应物 | B.增大体系的压强 |
| C.升高温度 | D.使用催化剂 |
已知:2SO2(g)+O2(g) 2SO3(g)ΔH="-197" kJ·mol-1。实验测得4 mol SO2参加上述反应放出354 kJ热量,则SO2的转化率最接近于( )
2SO3(g)ΔH="-197" kJ·mol-1。实验测得4 mol SO2参加上述反应放出354 kJ热量,则SO2的转化率最接近于( )
| A.90% | B.80% | C.50% | D.40% |
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得图,则曲线a、b、c、d所对应的实验组别可能是( )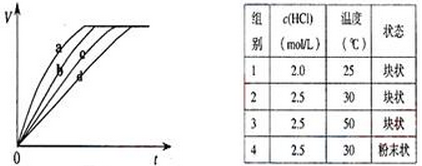
| A.4-3-2-1 | B.1-2-3-4 |
| C.3-4-2-1 | D.1-2-4-3 |
某反应的ΔH=+100 kJ·mol-1,下列有关该反应的叙述正确的是( )
| A.正反应活化能小于100 kJ·mol-1 |
| B.逆反应活化能一定小于100 kJ·mol-1 |
| C.正反应活化能不小于100 kJ·mol-1 |
| D.正反应活化能比逆反应活化能大100 kJ·mol-1 |
在体积固定为2 L的密闭容器中,A、B、C、D四种气体的物质的量n(mol)随时间t(min)的变化情况如图所示。下列有关说法不正确的是( )
A.该反应的化学方程式为4A+5B 6C+4D
6C+4D
B.前2 min用B表示的反应速率约为0.002 1 mol·L-1·s-1
C.2 min时,外界条件的改变可能是升高温度或加入了催化剂
D.该反应为放热反应