化学反应过程中发生物质变化的同时,常常伴有能量的变化。这种能量的变化常以热量的形式表现出来,叫做反应热。由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热等。
(1)下列 △ H 表示物质燃烧热的是_______(填字母编号)。

(2)依据上述热化学方程式,稀硝酸与氢氧化钾溶液发生中和反应的热化学方程式为______________(其中热效应从上述 △H1~△H7尽中选取)。
(3)中和热的测定是高中化学的定量实验之一。50 mL0.50 mol/L 盐酸与 50 mL 0.55 mol/L NaOH 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。从实验装置上看,图中尚缺少的一种仪器是_______。大烧杯上如不盖硬纸板,求得的中和热数值将会_______(填“偏大”、“偏小”或“无影响”)。
已知:①有机化学反应因反应条件不同,可生成不同的有机产品。例如: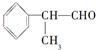
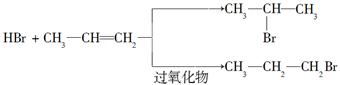
②苯的同系物与卤素单质混合,若在光照条件下,侧链烃基上的氢原子被卤素原子取代;若在催化剂作用下,苯环某些位置上的氢原子被卤素原子取代。
工业上利用上述信息,按下列路线合成结构简式为的物质,该物质是一种香料。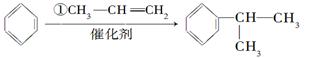
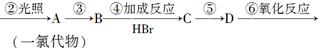
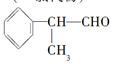
请根据上述路线,回答下列问题:
(1)A的结构简式可能为_____________、____________________。
(2)反应③的反应类型为_________________;反应⑤的条件是_______________
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件,下同):
__________________________________________________。
(4)工业生产中,中间产物A须经反应③④⑤得D,而不采取将A直接转化为D的方法,其原因是____________________________。
(5)检验产品中官能团的化学反应方程式为:_____________________________。
(6)这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液呈紫色;②苯环上的一溴代物有两种;③分子中没有甲基。写出一种符合上述条件的物质可能的结构简式:。
某烃A的相对分子质量为84。回答下列问题:
(1)下列物质与A以任意比例混合,若总物质的量一定,充分燃烧消耗氧气的量不相等的是(填序号)________。
a.C7H12O2b.C6H14c.C6H14Od.C7H14O3
(2)若烃A为链烃,与HBr加成后只能得到一种产物,且该烃的一氯代物只有一种。
①A的结构简式为________________;
②链烃A与Br2的CCl4溶液反应生成B,B与NaOH的醇溶液共热可得到D,D分子中无溴原子。请写出由B制备D的化学方程式:__________________;
③B与足量NaOH水溶液完全反应,生成有机物E,该反应的化学方程式:____________________________;E与乙二醇的关系是_______________。
(3)若核磁共振氢谱显示链烃A有三组不同的峰,峰面积比为3:2:1,则A的名称为________________。(4)若A不能使溴水褪色,且其一氯代物只有一种,则A的结构简式为
某种兴奋剂的结构简式如图: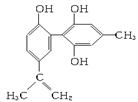
回答下列问题:
(1)该物质与苯酚____________(填“是”或“不是”)同系物。
(2)该兴奋剂与FeCl3溶液混合,现象是_______________________。
(3)滴入酸性KMnO4溶液,振荡,紫色褪去,________(填“能”或“不能”)证明其结构中含有碳碳双键。理由是:_________________。
(4)1 mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为________mol和________mol。
Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下: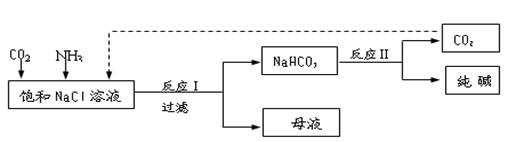 k+s-5#
k+s-5#
已知NaHCO3在低温下溶解度较小。反应Ⅰ为:NaCl+CO2+NH3+H2O NaHCO3↓+NH4Cl,处理母液的两种方法如下:
NaHCO3↓+NH4Cl,处理母液的两种方法如下:
(1)向母液中加入石灰乳,可将其中________循环利用。
(2)向母液中通入NH3,加入细小的食盐颗粒并降温,可得到NH4Cl晶体。试写出通入NH3后,溶解度较小的酸式碳酸盐转变为溶解度较大的碳酸盐的离子方程式 _____________________________。
Ⅱ.某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及下图所示装置制取NaHCO3,然后再将NaHCO3制成Na2CO3。
(1)装置丙中冷水的作用是;
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有_______、洗涤、灼烧。NaHCO3转化为Na2CO3的化学方程式为;
(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1 min的NaHCO3样品的组成进行了以下探究。取加热了t1 min的NaHCO3样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如图所示。则曲线a对应的溶液中的离子是___________(填离子符号下同);曲线c对应的溶液中的离子是___________;该样品中NaHCO3和Na2CO3的物质的量之比是;
(4)若取21.0 g NaHCO3固体,加热了t2 rnin后,剩余固体的质量为l4.8 g。如果把此剩余固体全部加入到200 mL 2 mol•L—1的盐酸中,则充分反应后溶液中H+ 的物质的量浓度为____________(设溶液体积变化忽略不计)
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。制备ClO2有下列两种方法:
方法一:2 NaClO3+4 HCl="2" ClO2↑+ Cl2↑+ 2 NaCl+2 H2O
方法二:2 NaClO3+H2O2+H2SO4=2 ClO2↑+ O2↑+Na2SO4+2 H2O
(1)方法一的离子方程式为;
(2)方法二中被氧化的物质是,若反应中有0.1mol电子转移,则产生的ClO2气体在标准状况下的体积为L;在下面的化学式上标出电子转移的方向和数目
2 NaClO3+H2O2+H2SO4=2 ClO2↑+ O2↑+ Na2SO4+2 H2O
(3)某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO—与ClO3—的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为;