芒硝化学式Na2SO4·10H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物。该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是提高原料的利用率而言都更加符合绿色化学理念。
(1)该电解槽的阳极反应式为_______________。此时通过阴离子交换膜的离子数_______________(填“大于”或“小于”或“等于”)通过阳离子交换膜的离子数。
(2)制得的氢氧化钠溶液从出口_______________(填写“A”、“B”、“C”、“D”)导出。
(3)通电开始后,阴极附近溶液pH会增大,请简述原因_______________。
(4)若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,则电池负极的电极反应式为_______________。已知H2的燃烧热为285.8 kJ/mol,则该燃料电池工作产生36 g H2O时,理论上有_______________kJ的能量转化为电能。
( 14分)(1)3.6克H2O的物质的量是,含有个H2O,含有molH。
(2)3.01×1023个OH—的物质的量为,质量为,含有质子的物质的量为,含有电子的物质的量为。
某校课外小组同学制备Fe(OH)3胶体,并研究该胶体的性质。
(1)该小组同学采用了以下操作制备胶体,请将空白处填写完整。
取一个烧杯,加入20mL蒸馏水,加热至沸腾,然后向烧杯中滴加5~6滴饱和_______ ___溶液,继续煮沸,至出现_________后,停止加热;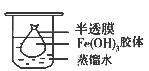
(2)将制得的胶体放入半透膜制成的袋内,如上左图所示,放置2min后,取少量半透膜外的液体于试管中,置于暗处,用一束强光从侧面照射,观察(填写“有”或“无”)_________ 丁达尔现象:再向试管中加入用稀硝酸酸化的硝酸银溶液,可观察到的现象为______________________________;
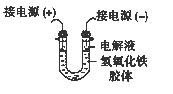
(3)将半透膜内的液体倒入U 型管中,如上右图所示,在液体上方加入少量电解液以保护胶体,接通直流电后,观察到的现象是(填“阴”或“阳”)_____极附近颜色逐渐变深,其原因是_____________________________________。
有下列物质:①氢氧化钠固体 ②铝片 ③氯化氢气体 ④稀硫酸
⑤干冰 ⑥氨水 ⑦碳酸钠粉末 ⑧蔗糖晶体 ⑨熔融氯化钠
⑩CuSO4•5H2O晶体。请用序号填空:
(1)上述状态下可导电的是________。
(2)属于电解质的是________。
(3)属于非电解质的是________。
(4)上述状态下的电解质不能导电的是________。
在标准状况下,(a)4 g H2(b)11.2 L O2(c)27mL H2O中,所含分子数最多的是(填序号)①_________,含原子数最多的是②,体积最大的是③,质量由大到小的顺序是④。
根据图示填空。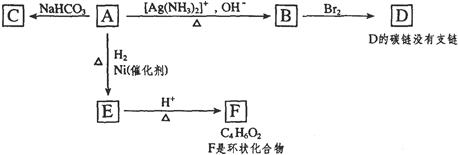
(1)化合物A含有的官能团是。
(2)1mol A与2mo H2反应生成1moE,其反应方程式是。
(3)与A具有相同官能团的A的同分异构体的结构简式是。
(4)B在酸性条件下与Br2反应得到D,D的结构简式是。
(5)F的结构简式是。由E生成F的反应类型是。