在100 ℃时,将0.100 mol N2O4气体充入1 L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得到如表数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| c(N2O4)/mol·L-1 |
0.100 |
c1 |
0.050 |
c3 |
c4 |
| c(NO2)/mol·L-1 |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
(1)该反应的平衡常数表达式为________;从表中分析:c1________c2,c3________c4(填“>”、“<”或“=”)。
(2)在上述条件下,从反应开始直至达到化学平衡时,N2O4的平均反应速率为________mol·L-1·s-1。
(3)达平衡后下列条件的改变可使NO2气体浓度增大的是________(填字母序号)。
A.扩大容器的容积
B.再充入一定量的N2O4
C.分离出一定量的NO2
D.再充入一定量的He
(4)若在相同条件下,起始时只充入0.080 mol NO2气体,则达到平衡时NO2气体的转化率为________。
已知有机化合物 A、B、C、D、E存在下图所示转化关系,且C能跟NaHCO3发生反应,C和D的相对分子质量相等,E为无支链的化合物。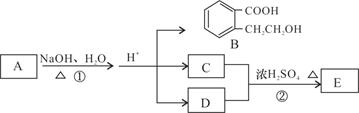
请回答下列问题:
(1)已知E的相对分子质量为102,其中碳、氢两种元素的质量分数分别为58.8%、9.8%,其余为氧,则E的分子式为。
(2)B在一定条件下可以发生缩聚反应生成某高分子化合物,此高分子化合物的结构简式为。
(3)C的核磁共振氢谱中有个峰;D也可以由卤代烃F在NaOH溶液中加热来制取,写出此反应的化学方程式。
(4)A的结构简式是。
(5)B有多种同分异构体,请写出一种同时符合下列四个条件的结构简式:。
a.能够发生水解 b.能发生银镜反应
c.能够与FeCl3溶液显紫色 d.苯环上的一氯代物只有一种
有机物A的结构简式为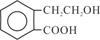 ,可通过它用不同化学反应分别制得B、C和D 三种物质。
,可通过它用不同化学反应分别制得B、C和D 三种物质。
B 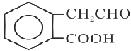 C
C 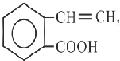 D
D 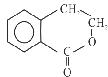
(1)B中的含氧官能团名称是;A→C的反应类型是。
(2)由A生成B的化学方程式是。
(3)C在一定条件下发生加聚反应的化学方程式是。
(4)C的同分异构体中,有多种反式结构,写出其一种的结构简式。
(5)D在酸性条件下水解的化学方程式是。
聚苯乙烯的结构为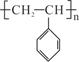 ,试回答下列问题:
,试回答下列问题:
(1)聚苯乙烯的链节是_________________,单体是___________________;
(2)实验测得聚苯乙烯的相对分子质量(平均值)为52000,则该高聚物的聚合度n为________________。
观察下列结构简式,回答下列问题:
(1)有机物名称是__________________________。
(2)此有机物为单烯烃加成的产物,则原来烯烃的结构可能有_______种。
如下图,回答问题:
(1)A装置是将能转化为能。
(2)Zn是极, 电极反应式为 ; Cu电极反应式为 ;
Pt是极, 电极式为 ;石墨电极反应式为 。
(3)电解一段时间后发现石墨电极增重6.4g,则外电路中通过的电子的物质的量是 摩尔, 