(1)某同学以H2O2分解为例,探究浓度与溶液酸碱性对反应速率的影响。常温下,按照如表所示的方案完成实验。
| 实验编号 |
反应物 |
催化剂 |
|
| a |
50 mL 5% H2O2溶液 |
|
1 mL 0.1 mol· L-1 FeCl3溶液 |
| b |
50 mL 5% H2O2溶液 |
少量浓盐酸 |
1 mL 0.1 mol· L-1 FeCl3溶液 |
| c |
50 mL 5% H2O2溶液 |
少量浓 NaOH溶液 |
1 mL 0.1 mol· L-1 FeCl3溶液 |
| d |
50 mL 5% H2O2溶液 |
|
MnO2 |
①测得实验a、b、c中生成氧气的体积随时间变化的关系如图1所示。

由该图能够得出的实验结论是__________________________。
②测得实验d在标准状况下放出氧气的体积随时间变化的关系如图2所示。解释反应速率变化的原因:_______________________________。
(2)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应
TaS2(s)+2I2(g) TaI4(g)+S2(g) ΔH>0 ,
TaI4(g)+S2(g) ΔH>0 ,
①反应的平衡常数表达式K=________ ,若K=1,向某恒容密闭容器中加入1 mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为________。

图3
②如图3所示,上面反应在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净的TaS2晶体,则温度T1________T2(填“>”“<”或“=”)。上述反应体系中循环使用的物质是________。
芳香酯类化合物A、B互为同分异构体,均含C、H、O三种元素。并且各有机物间存在如下转化关系:
其中C能发生银镜反应,F经连续氧化可生成C;C与D是相对分子质量相同的不同类有机物。
(1)C中所含官能团的名称是。
(2)A的分子式是。B的结构简式是。
(3)完全燃烧时,1 mol D与1 mol 下列的耗氧量相同(填字母代号)。
a.C3H6O3 b.C3H8O c.C2H4 d.C2H6O2
(4)C与F反应的化学方程式是,反应类型是____________。
(5)水杨酸 的同分异构体很多,写出其中含苯环且属于酯类的所有同分异构体的结构简式:。
的同分异构体很多,写出其中含苯环且属于酯类的所有同分异构体的结构简式:。
有关元素X、Y、Z、W的信息如下
| 元素 |
有关信息 |
| X |
所在主族序数与所在周期序数之差为4 |
| Y |
最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子 |
| Z |
单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
| W |
地壳中含量最高的金属元素 |
请回答下列问题:
(1)W的单质与Y的最高价氧化物对应的水化物反应的离子方程式为。
铜片、碳棒和ZX3溶液组成原电池,写出正极发生的电极反应方程式
_______________________________________________。
(2)向淀粉碘化钾溶液中滴加几滴ZX3的浓溶液,现象为_____________________,相关反应的离子方程式为_______________________________。
(3)以上述所得WX3溶液为原料制取无水WX3,先制得WX3·6H2O晶体,主要操作包括__________________________,在_____________________条件下加热WX3·6H2O晶体,能进(4)一步制取无水WX3,其原因是(结合离子方程式简要说明)_______________________________。
以下为中学常见物质,转化关系如下。C与B溶液反应产生气体F,D可在F中燃烧,图中部分产物略去。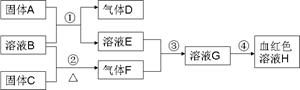
(1)写出固体C化学式;
(2)实验室用①制取D,B溶液应为溶液(“浓”或“稀”);若用②制取F,B溶液应为溶液(“浓”或“稀”)。写出②反应方程式;
(3)如何检验中的阳离子;
(4)实验室配制G溶液,操作为;
(5)除③可实现E→G外,请用其他物质实现E→G,化学方程式。
在碱存在的条件下,卤代烃与醇反应生成醚(R-O-R′):
化合物A经下列四步反应可得到常用溶剂四氢呋喃,反应框图如下: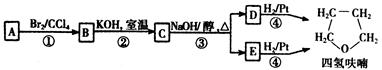
请回答下列问题:
(1)1 mol A和1 mol H2在一定条件下恰好反应,生成饱和一元醇Y,Y中碳元素的质量分数约为65%,则Y的分子式为 __________________________
A分子中所含官能团的名称是 __________________________
A的结构简式为__________________________。
(2)第①②步反应类型分别为① _____________ ② _____________。
(3)化合物B具有的化学性质(填写字母代号)是 _____________。
a.可发生氧化反应 b.强酸或强碱条件下均可发生消去反应
c.可发生加成反应 d.催化条件下可发生加聚反应
(4)写出C、D和E的结构简式:
C _____________ D ___________________E_____________
(5)写出化合物C与NaOH水溶液反应的化学方程式:
_____________________________________________________________________________
(6)写出四氢呋喃链状醚类的所有同分异构体的结构简式:
_____________________________________________________________________________
____________________________________________________________________________
已知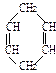 可简写为
可简写为 。现有某化合物W的分子结构可表示为:
。现有某化合物W的分子结构可表示为:
(1)W的分子式为 ____________。
(2)W的一氯代物有____________ 种。
(3)下列有关W的说法不正确的是 ____________(填编号)。
a.能发生还原反应 b.能发生氧化反应 c.能发生加聚反应
d.等质量的W与苯分别完全燃烧所消耗的氧气量,前者大
(4)写出W的芳香族同分异构体(能发生聚合反应)的结构简式____________,写出该聚合反应的化学方程式_____________________。
(5)W属于____________(填编号)。
a.芳香烃 b.环烃 c.不饱和烃 d.炔烃