常温下,下列离子浓度的关系正确的是( )
| A.pH=2的盐酸与pH=12的氨水等体积混合:c(NH4+)=c(Cl-)>c(H+)=c(OH-) |
| B.0.2 mol·L-1的CH3COONa溶液与0.1 mol·L-1的HCl等体积混合: c(Na+)>c(Cl-)>c(CH3COO-)>c(H+)>c(OH-) |
| C.0.1 mol·L-1的HCN(弱酸)和0.1 mol·L-1的NaCN等体积混合: c(HCN)+c(CN-)+c(OH-)=c(Na+)+c(H+) |
| D.相同物质的量浓度时,溶液中c(NH4+)由大到小的顺序:NH4Al(SO4)2>NH4Cl>CH3COONH4>NH3·H2O |
对于平衡体系2SO2(g)+O2(g)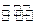 2SO3(g)△H<0。下列结论中正确的是()
2SO3(g)△H<0。下列结论中正确的是()
| A.若温度不变,将容器的体积增大一倍,此时的SO2浓度变为原来的0.5倍 |
| B.若平衡时SO2、O2的转化率相等,说明反应开始时,两者的物质的量这比为2:1 |
| C.若从平衡体系中分离出SO2,则有利于提高SO2的转化率和加快正反应速率 |
| D.平衡状态时SO2、O2、SO3的物质的量之比一定为2:1:2 |
下列操作后,溶液pH减小的是()
| A.适当升高Na2CO3溶液的温度 | B.往氨水中加入NH4Cl固体 |
| C.往氨水中加入CaCO3固体 | D.用石墨作电极电解NaCl溶液 |
下列有关化学反应原理的应用叙述正确的是()
| A.用明矾净水是因为Al2+水解生成的Al(OH)3胶粒具有很强的吸附性 |
| B.合成氨生成过程中,采用高温高压都是为了提高N2、H2转化率 |
| C.往铁钉镀铜时,用铜做阴极 |
| D.电解饱和食盐水制烧碱,NaOH在阳极区域产生 |
现有10g镁铝合金与足量的稀硫酸充分反应后,共收集到标况下的气体体积11.2L,向反应后的溶液中滴加NaOH溶液至沉淀达最大值,过滤、洗涤、干燥后得沉淀的质量为()
| A.18.5G | B.27g | C.21g | D.24.5g |
咖啡酸可用作化学原料和中间体,其结构如图所示。下列关于咖啡酸说法不正确的是()
| A.能发生加聚反应 |
| B.能使高锰酸钾溶液褪色 |
| C.1mol咖啡酸最多能与3mol NaOH反应 |
D.1mol咖啡酸最 多能与3mol Br2反应 多能与3mol Br2反应 |