为了探索外界条件对反应:aX(g)+bY(g) cZ(g) 的影响,将X和Y以物质的量之比为a∶b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。下列判断正确的是( )
cZ(g) 的影响,将X和Y以物质的量之比为a∶b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。下列判断正确的是( )
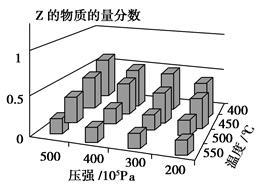
| A. ΔH<0,a+b>c | B. ΔH>0,a+b<c |
| C. ΔH>0,a+b>c | D. ΔH<0,a+b<c |
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是
| A.加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好 |
| B.加热时,②、③溶液均变红,冷却后又都变为无色 |
| C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅 |
| D.四个“封管实验”中所发生的化学反应都是可逆反应 |
下列分类或归类正确的是:
①铝热剂、纯净矿泉水、冰水混合物均为混合物 ②NaOH、HD、IBr均为化合物
③明矾、烧碱、硫酸均为强电解质 ④C60、金刚石、石墨均为碳的同素异形体
⑤碘酒、淀粉溶液、水雾、纳米材料均为胶体
A.①②③⑤ B.③④⑤ C.②④⑤ D.③④
化学与能源开发、环境保护、资源利用等密切相关,下列说法正确的是
| A.硅酸钠的水溶液俗称水玻璃,可用作木材防火剂 |
| B.开发核能、太阳能等新能源,推广基础甲醇汽油,使用无磷洗涤剂都可直接降低碳排放 |
| C.在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀 |
| D.汽车尾气中含有氮的氧化物,是汽油不完全燃烧造成的 |
元素A和B的原子序数都小于18,已知A原子最外层电子数为a个,次外层电子数为b个;B原子M层电子数为(a-b)个,L层为(a+b)个。则A、B两种元素形成化合物的性质可能
A.能与水反应B.能与硫酸反应
C.能与氢氧化钠反应D.能与碳酸钠反应
下列实验装置设计正确、且能达到目的的是
| A.实验I:检查装置的气密性 |
| B.实验II:测定未知盐酸的浓度 |
| C.实验III:比较硫、碳、硅三种元素的非金属性强弱 |
| D.实验IV:定容 |