下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
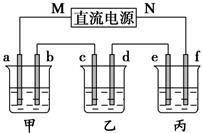
(1)接通电源,经过一段时间后,测得丙中K2SO4质量分数为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为_______________________极;
②电极b上发生的电极反应为________________________;
③电极b上生成的气体在标准状况下的体积为__________L;
④电极c的质量变化是_________g;
⑤电解前后各溶液的pH是否发生变化:
甲溶液___________________________;
乙溶液___________________________;
丙溶液___________________________;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么? _______________________________。
向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式___________________________________________________。
(2)下列三种情况下,离子方程式与(1)相同的是______(填序号)。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO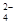 恰好完全沉淀
恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用下图中的 ______曲线表示(填序号)。
【化学——选修3:物质结构与性质】
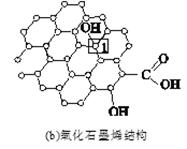
石墨烯[如图(a)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示。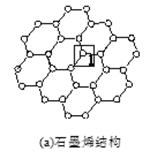
(1)基态碳原子的核外电子有_________种运动状态。
(2)图(a)中,1号C与相邻C形成σ键的个数为________。
(3)图(b)中,1号C的杂化方式是________,该C与相邻C形成的键角________(填“>”“<”或“=”)图(a)中1号C与相邻C形成的键角。
(4)若将图(b)所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有________(填元素符号)。
(5)石墨烯可转化为富勒烯分子(C60),C60属于________晶体,某金属M与C60可制备一种低温超导材料,晶胞如图所示,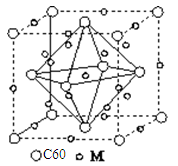
M原子位于晶胞的棱上与内部。该晶胞中M原子的个数为________,该材料的化学式为________。
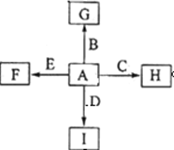
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:
①反应C+G B+H能放出大量的热,G是红综色固体粉末;
B+H能放出大量的热,G是红综色固体粉末;
②I是一种常见的温室气体,它和E可以发生反应:2E+I 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.
回答问题:
(1)①中反应的化学方程式为____________________________________
(2) 1.6gG溶于盐酸,得到的溶液与铜粉完全反应,至少需要铜粉_______克
(3) C与过量NaOH溶液反应的离子方程式为________________________,反应后的溶液与过量的化合物I反应的离子方程式为________________________________
(4) E与I反应的化学方程式为__________________________________
(5) 写出H物质在工业上的一种用途_____________。
(6)将一定量的B完全溶于过量盐酸中,然后通入0.005mol Cl2,再加入0.01mol重铬酸钾晶体(K2Cr2O7),恰好使溶液中B2+全部转化为B3+,铬元素本身被还原为+3价铬离子。通过计算确定原B的物质的量为()
A.0.01molB.0.03mol C.0.04mol D.0.07mol
(13分)三氟化氮(NF3)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素原子的物质的量之比为__________.
(2)写出该反应的化学方程式____________________________________________.
若反应中生成0.2 mol HNO3,转移的电子数目为________个.
(3) 三氟化氮可由氨气和氟气反应得到:4NH3+3F2=NF3+3NH4F ,据题意推测 NF3、F2、NO三种气体中,氧化性由弱到强的顺序为____________________
(4)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现.你判断该气体泄漏时的现象是___________________________________________________.
(5)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外,还肯定有____________________________(填化学式).
某研究性学习小组对铝热反应实验展开研究。现行高中化学教材(必修加选修)中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
| 熔点/℃ |
660 |
2054 |
1535 |
1462 |
| 沸点/℃ |
2467 |
2980 |
2750 |
- |
I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:_________________(填“合理”或“不合理)
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是______________,反应的离子方程式为_________________________________。
(3)实验室溶解该熔融物,下列试剂中最好的是____________(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。 试回答下列问题:
试回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为________________。
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式_______________;
上述现象说明溶液中_________________结合OH-的能力比_______强(填离子符号)。
(3) B与A的差值为_________mol。B点对应的沉淀的物质的量为________mol,C点对应的氢氧化钠溶液的体积为___________mL