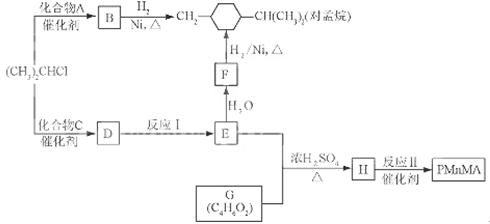
优良的有机溶剂对孟烷、耐热型特种高分子功能材料PMnMA的合成路线如下:
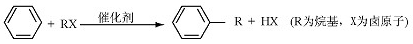
己知芳香化合物苯环上的氢原子可被卤代烷中的烷基取代。如:
(1)B为芳香烃。
①由B生成对孟烷的反应类型是 。
②(CH3)2CHCl与A生成B的化学方程武是 。
③A的同系物中相对分子质量最小的物质是 。
(2)1.08g的C与饱和溴水完全反应生成3.45 g白色沉淀。E不能使Br2的CC14溶液褪色.
①F的官能团是 。
②C的结构简式是 。
③反应I的化学方程式是 。
(3)下列说法正确的是(选填字母)
a.B可使酸性高锰放钾溶液褪色 b.C不存在醛类同分异构体
c.D的酸性比E弱 d.E的沸点高于对孟烷
(4)G的核磁共振氢谱有3种峰,其峰面积之比为3:2:1。G与NaHCO3反应放出CO2。反应II的化学方程式是 。
(8分)通过简单地推理或计算填空:
(1)X原子有两个电子层,它能与最活泼的金属Y形成Y3X的化合物,X是_______元素(写元素符号)。
(2)若某元素原子的电子层数和Na原子的相同,最外层电子数与F原子相同,则该元素的原子序数是_______。
(3)6C元素能够与某非金属元素R形成化合物CRn,已知CRx分子中各原子核外最外层电子总数为32,核外电子数总和为74。则R是_______元素(写元素符号),n=_______。
(4)有A、B、C、D、E五种短周期元素,其元素特征信息如下表:
| 元素编号 |
元素特征信息 |
| A |
其单质是密度最小的物质 |
| B |
阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C |
其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D |
其氢氧化物和氧化物都有两性,与C同周期 |
| E |
与C同周期,原子半径在该周期最小 |
①写出E单质与A、B、C形成的化合物反应的化学方程式: ____________.
②D单质与A、B、C形成的化合物的水溶液反应的离子方程式:____________.
将气体A、B置于容积为2L的密闭容器中,发生如下反应:3A(g) +B(g)  2C(g)+2D(g),反应进行到10s末,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
2C(g)+2D(g),反应进行到10s末,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
(1)用生成物C的浓度增加来表示该反应的速率为:;
(2)反应前A、B的物质的量浓度分别是:、。
(3)10s末,生成物D的浓度为。
为了防止铁被腐蚀,常在铁皮表面镀上一层较耐腐蚀的金属,如镀锌铁和镀锡铁,若罐头欲装蕃茄酱,该罐头的材料应选用上述的铁。各取一小块镀锌铁皮和镀锡铁皮,用小刀在上面刻划,露出里面的铁,然后在刻痕上滴一滴氯化钠溶液,再滴一滴K3[Fe(CN)6]溶液(K3[Fe(CN)6]溶液遇到Fe2+会出现蓝色沉淀),静置数分钟后先出现蓝色沉淀现象的哪一块铁片?;
在铁片上发生的电极反应式为;
在另一种金属上发生的电极反应式为。
(7分)下图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合。
(1)图中属于烷烃的是,用分子式表示为
(2)上图中互为同分异构体的是:A与;B与;D与。(填编号)
下图中A、B、C、D是同周期或同主族的相邻元素:
(1)已知:A元素的最低价为-3价,它的最高价氧化物含氧56.34%,原子核内中子数比质子数多1个,则A元素原子的质量数为 ,原子序数为_______,A元素在元元素周期表中的位置为_ ____。
____。
(2)写出元素符号A________B________,C ,D _________。
_________。
(3)A、B、C三种元素最高 价氧化物的水化物的化学式为 , , ,其中酸性最强的是___
价氧化物的水化物的化学式为 , , ,其中酸性最强的是___ ______。
______。
(4)B、D两种元素和氢组成的气态氢 化物的化学式依次为__________, ,其中________稳定性最大,________还原性最强。
化物的化学式依次为__________, ,其中________稳定性最大,________还原性最强。