(1)可正确表示原子轨道的是 。
A.2s B.2d C.3p D.3f
(2)写出基态镓(Ga)原子的电子排布式 。
(3)下列物质变化,只与范德华力有关的是 。
A.干冰熔化
B.乙酸汽化
C.乙醇与丙酮混溶
D. 溶于水
溶于水
E.碘溶于四氯化碳
F.石英熔融
(4)下列物质中,只含有极性键的分子是 ,既含离子键又含共价键的化合物是 ;只存在σ键的分子是 ,同时存在σ键和π键的分子是 。
A N2 B CO2 C CH2Cl2 D C2H4E.C2H6 F CaCl2 G NH4Cl
(5)用“>”“<”或“=”填空:
第一电离能的大小:Mg Al;熔点的高低:KCl MgO。
能量之间可相互转化:
(1)电解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。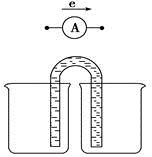
①完成原电池甲的装置示意图(见上图),并作相应标注,要求:在同一烧杯中,电极与溶液含相同的金属元素。
②以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极__________。
③甲乙两种原电池可更有效地将化学能转化为电能的是________,其原因是______________________________。
(2)根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在(1)的材料中应选__________作阳极。
氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72 LH2(已折算成标准状况)。甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25 g/L。请回答下列问题:
(1)甲的化学式是_________;乙的电子式是__________。
(2)甲与水反应的化学方程式是__________________________________。
(3)气体丙与金属镁反应的产物是_______(用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式_________。有人提出产物Cu中可能还含有Cu2O,请设计实验方案验证之______________。(已知Cu2O+2H+==Cu+Cu2++H2O)
(5)甲与乙之间_______(填“可能”或“不可能”)发生反应产生H2,判断理由是________。
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2 ,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氧化钠辖液电解实验,如图所示。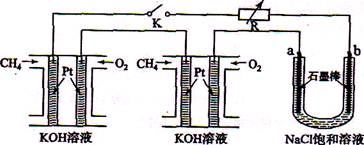
回答下列问题:
(1)甲烷燃料电池正极、负极的电极反应分别为、。
(2)闭合K开关后,a、b电极上均有气体产生.其中b电极上得到的是,电解氯化钠溶液的总反应方程式为;
(3)若每个电池甲烷通如量为1 L(标准状况),且反应完全,则理论上通过电解池的电量为(法拉第常数F=9.65×l04C · mol-1列式计算),最多能产生的氯气体积为L(标准状况)。
如图是现今常规生产发烟硫酸和硫酸的流程图: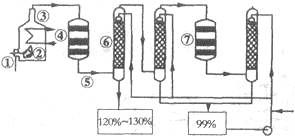
(1)在④处二氧化硫被氧化成三氧化硫,④的设备名称是,该处发生反应的方程式为,为提高三氧化硫的产率,该处应采用(填“等温过程”或“绝热过程”)为宜。
(2)在⑦处进行二次催化处理的原因是。
(3)⑤处气体混合物主要是氮气和三氧化硫.此时气体经过⑥后不立即进入⑦是因为。
(4)20%的发烟硫酸(SO3的质量分数为20%)1吨需加水吨(保留2位有效数字)才能配制成98%的成品硫酸。
(5)在②处发生1500℃的“不完全燃烧”,即先混入少量干燥空气,然后在③处于700℃下再继续燃烧.试简述这种燃烧方式对环境保护是有利的原因。
A~F均为元素周期表中前四周期元素,其相关信息如下表:
| 元素 |
相关信息 |
| A |
A的基态原子最外层电子排布式为2s22p3 |
| B |
B是地壳中含量最高的元素 |
| C |
C+与B的简单离子的电子层结构相同 |
| D |
D的一种核素的质量数为64,中子数为35 |
| E 、F |
E 、F既同周期又同族,且原子序数F比E多2 |
请回答下列问题:
(1)D的价电子的电子排布式是;F原子的原子结构示意图为。
(2)A、B的第一电离能的大小顺序为。
(3)AB3-中A原子的杂化轨道类型为_____;与A2B互为等电子体的分子的分子式为(任写一个即可)。
(4) D晶体的晶胞如图所示为面心立方最密堆积(在晶胞的顶点和面心均含有一个D原子)。则D的晶体中D原子的配位数为。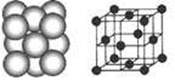
(5)已知17gA的简单氢化物催化氧化生成气态水时放出QkJ的热量,请写出A的简单氢化物催化氧化的热化学反应方程式。
(6)C2B2的电子式为____;它可与E的二氯化物溶液反应,若反应的C2B2与E的二氯化物的物质的量之比为1:2,则该反应的化学反应方程式为。