氢能的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①Ti2+基态的电子排布式可表示为 。
②B的空间构型是 (用文字描述)。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2 2NH3实现储氢和输氢。下列说法正确的是 。
2NH3实现储氢和输氢。下列说法正确的是 。
a.NH3分子中N原子采用sp3杂化
b.相同压强时,NH3沸点比PH3高
c.[Cu(NH3)4]2+中,N原子是配位原子
d.CN-的电子式为[∶C︙︙N∶]-
(3)2008年,Yoon等人发现Ca与C60生成的Ca32C60能大量吸附H2分子。

C60分子结构
①C60晶体易溶于苯、CS2,说明C60是 分子(选填“极性”或“非极性”)。
②1 mol C60分子中,含有σ键数目为 。
(4)MgH2是金属氢化物储氢材料,其晶胞结构如图所示,已知该晶体的密度为a g·cm-3,则晶胞的体积为 cm3[用a、NA表示(NA表示阿伏加德罗常数的数值)]。

(I)向一体积不变的密闭容器中充入2 mol A,0.6 mol C和一定量的B三种气体,一定条件下发生反应2A(g)+B(g) 3C(g),各物质的浓度随时间变化的关系如图 1所示,其中t0~t1阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况且t2,t3,t4各改变一种不同的条件。
3C(g),各物质的浓度随时间变化的关系如图 1所示,其中t0~t1阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况且t2,t3,t4各改变一种不同的条件。
(1)若t1=15 min,则t0~t1阶段以C的浓度变化表示的反应速率v(C)=__________。
(2)t3时改变的条件为__________________,B的起始物质的量为__________________,
(3)t4~t5阶段,若A的物质的量减少了0.01 mol,而此阶段中反应体系吸收能量为a kJ,
写出此条件下该反应的热化学方程式:__________________。
(II)在容积可变的密闭容器中发生反应:mA(g) + nB(g)  pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
| 压强p/Pa |
2×105 |
5×105 |
1×106 |
| c(A)/mol·L-1 |
0.08 |
0.20 |
0.44 |
⑴当压强从2×105 Pa增加到5×105 Pa时,平衡 移动(填:向左, 向右 ,不)
⑵维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是 mol。
⑶当压强为1×106 Pa时,此反应的平衡常数表达式: 。
维拉左酮是临床上使用广泛的抗抑郁药,其关键中间体合成路线如如: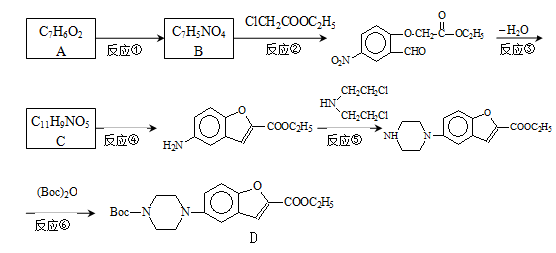
已知:①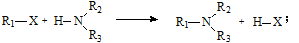
②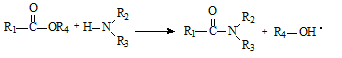
(1)反应类型:反应④ 反应⑤
(2)结构简式:A C
(3)写出反应②的化学方程式: 。
实验中反应②必须在碳酸钾弱碱性条件下进行的原因是 。
(4)合成过程中反应③与反应④不能颠倒的理由为 。
(5)反应⑥中,(Boc)2是有由两分子C5H10O3脱水形成的酸酐,写出分子式为C5H10O3,且分子中只含有2种不同化学环境氢原子,能发生水解反应的结构简式(书写2种): 、 。
(6)实验室还可以用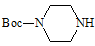 和
和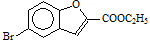 直接反应生成D,但实验中条件控制不当会发生副反应生成副产物,写出副产物有机物的结构简式 。
直接反应生成D,但实验中条件控制不当会发生副反应生成副产物,写出副产物有机物的结构简式 。
Ⅰ.硼元素B在化学中有很重要的地位。硼的化合物在农业、医药、玻璃工业等方面用途很广。请回答下列问题:
(1)写出与B元素同主族的Ga元素的基态原子核外电子排布简式 。从原子结构的角度分析,B、N、O元素的第一电离能由大到小的顺序为 。
(2)立方氮化硼可利用人工方法在高温高压条件下合成,属于超硬材料。同数原子晶体的氮化硼(BN)比晶体硅具有更高硬度和耐热性的原因是 。
(3)在BF3分子中中心原子的杂化轨道类型是 ,SiF4微粒的空间构型是 。又知若有d轨道参与杂化,能大大提高中心原子成键能力,试解释为什么BF3、SiF4水解的产物中,除了相应的酸外,前者生成BF4-,后者却是生成SiF62-: 。
Ⅱ.图所示为血红蛋白和肌红蛋白的活性部分---血红素的结构: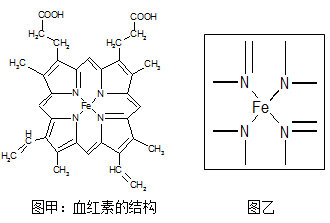
回答下列问题:
(1)根据元素电负性请判断H2N-CHO中碳和氮的化合价分别为 和 。
(2)血红素中两种氮原子的杂化方式分别为 , ;在图乙的方框内用“→”标出亚铁离子的配位键。
世界环保联盟建议全面禁止使用氯气对饮用水进行消毒,而建议采用高效“绿色‘消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体、易溶于水,不稳定,呈黄绿色。在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备二氧化氯的流程如图:
(1)二氧化氯中所有原子 (填“是”“不是”)都满足8电子结构。如图所示,用电解法制得的产物中,杂质气体B能是石蕊试液显蓝色,除去杂质气体可选用 (填序号)。
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品。下列说法正确的是 (填序号)。
A.二氧化氯克广泛用于工业和饮用水处理
B.二氧化氯的消毒效率比氯气的消毒效率高
C.稳定性二氧化氯的出现大大增加了二氧化硫的使用范围
D.在工作区和成品储藏室内,要有通风装置和监测及警报装置
(3)欧洲国家主要采用铝酸钠氧化浓盐酸制备二氧化氯。化学反应方程式为 。缺点主要是产率低,产品难以分离。还可能污染环境。
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备二氧化氯,化学方程式为 。此法相比欧洲方法的优点是 。
(5)科学家又研究出了一种新的制备方法,利用硫酸酸化的操作(H2C2O4)溶液还原铝酸钠,化学反应方程式为 。此法提高了生产及储存、运输的安全性,原因是。
草酸(乙二酸)可做还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如图。
回答下列问题:
(1)CO和氢氧化钠在一定条件下合成甲酸钠的化学反应方程式为 。
(2)该制备工艺中有两次过滤操作,过滤操作②的滤液是 ,滤渣是 。
(3)工艺过程中③和④的目的是 。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸,该方案的缺点是产品不纯,其中含有的杂质主要是 。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定,称量草酸成品0.250g溶于水,用0.05000mol/L的酸性高锰酸钾溶液滴定,至浅红色不消退,消耗高锰酸钾溶液15.00mL,反应的离子方程式为 ;列式计算该成品的纯度 。