室温下,用0.100mol·L﹣1 NaOH溶液分别滴定20.00mL 0.100mol·L﹣1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
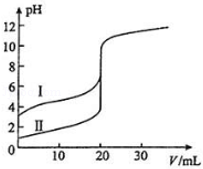
| A.Ⅱ表示的是滴定醋酸的曲线 |
| B.pH=7时,滴定醋酸消耗的V(NaOH)小于20mL |
| C.V(NaOH)=20.00mL时,两份溶液中c(Cl﹣)=c(CH3COO﹣) |
| D.V(NaOH)=10.00mL时,醋酸溶液中c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣) |
表中关于物质分类的正确组合是
| 类别 组合 |
酸性氧化物 |
碱性氧化物 |
酸 |
碱 |
盐 |
| A |
CO2 |
SiO2 |
H2SO4 |
Na2CO3 |
NaHCO3 |
| B |
CO |
Na2O |
HCl |
NaOH |
NaCl |
| C |
SO2 |
Na2O2 |
CH3COOH |
KOH |
CaF2 |
| D |
SO3 |
CaO |
HNO3 |
Ca(OH)2 |
CaCO3 |
在t ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g/mL,质量分数为ω,其中含有NH4+的物质的量是b mol,下列叙述正确的是
A.溶质的质量分数ω= ×100% ×100% |
B.溶质的物质的量浓度c=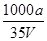 mo/L mo/L |
C.溶液中c(OH-)= mol/L+c(H+) mol/L+c(H+) |
| D.向上述溶液中加入V mL水,所得溶液的质量分数大于0.5ω |
配制0.1 mol/L的NaCl溶液,下列操作会导致所配溶液浓度偏高的是
| A.称量时,左盘高,右盘低 | B.定容时俯视读取刻度 |
| C.容量瓶洗净后未干燥 | D.定容时液面超过了刻度线 |
下列实验操作中,错误的是
| A.配制5%食盐溶液时,将称量的食盐放入烧杯中加适量的水搅拌溶解 |
| B.硫酸铜结晶水含量测定时,需用小火缓慢加热,防止晶体飞溅 |
| C.测定未知NaOH溶液浓度时,酸式滴定管需用标准酸液润洗2~3次 |
| D.配制0.1 mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释 |
有硫酸镁溶液500ml,它的密度为1.20g/cm3,其中镁离子的质量分数为4.8%,则有关该溶液的说法不正确的是
| A.溶质的质量分数为24.0% |
| B.溶液的物质的量浓度为2.4mol/L |
| C.溶质和溶剂的物质的量之比为1:40 |
| D.硫酸根离子的质量分数为19.2% |