用石墨电极分别电解下列足量物质的水溶液一段时间后,向剩余电解质溶液中加入一定量的一种物质(括号内),溶液能恢复到与原来溶液完全一样的是
| A.CuCl2(HCl) | B.NaOH(NaOH) | C.NaCl(HCl) | D.CuSO4[Cu(OH)2] |
下列说法正确的是
| A.润洗酸式滴定管时应从滴定管上口加入3~5mL所要盛装的酸溶液,倾斜着转动滴定管,使液体润湿其内壁,再从上口倒出,重复2~3次 |
| B.向酒精灯内添加酒精时,不能多于容积的2/3,若不慎洒出的酒精在桌上燃烧,应迅速用水灭火 |
| C.探究温度对反应速率的影响时,应先将硫代硫酸钠溶液、硫酸溶液分别在水浴中加热,然后混合 |
| D.在“金属析氢腐蚀”实验中,外面缠绕着铜丝的铁钉上产生气泡多,在铁钉周围出现血红色现象(溶液中滴加几滴KSCN溶液) |
【改编】常温下,在下列给定条件的各溶液中,一定能大量共存的离子组是
| A.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- |
| B.含有0.1 mol·L-1 Fe(NO3)2的溶液:H+、Mg2+、SCN-、Cl- |
| C.无色透明的溶液中:Cu2+、K+、SO42-、NO3- |
| D.由水电离产生的c(H+)=10-13mol·L-1的溶液:K+、SO42-、NO3-、Cl- |
乌头酸的结构简式如图所示,下列关于乌头酸的说法错误的是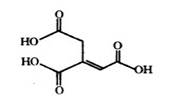
| A.化学式为C6H6O6 |
| B.乌头酸能发生水解反应和加成反应 |
| C.乌头酸能使酸性高锰酸钾溶液褪色 |
| D.含l mol乌头酸的溶液最多可消耗3 mol NaOH |
【改编】化学与能源开发、环境保护、生产生活等密切相关。下列叙述错误的是
| A.利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
| B.用聚乙烯塑料代替聚乳酸塑料可减少白色污染 |
| C.锅炉水垢中的硫酸钙可用碳酸钠溶液处理,使之转化为碳酸钙,再用酸除去 |
| D.改进汽车尾气净化技术,可减少大气污染物的排放 |
①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。相同条件下,有关上述溶液的比较中,不正确的是
| A.水电离的c(H+):①=②=③=④ |
| B.若将②、③溶液混合后,pH=7,则消耗溶液的体积:②=③ |
| C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:①最大 |
| D.向溶液中加入100mL水后,溶液的pH:③>④>②>① |