锌铜原电池装置如图所示,其中阴离子交换膜只允许阴离子和水分子通过,下列有关叙述正确的是
| A.铜电极上发生氧化反应 |
| B.电池工作一段时间后,甲池溶液的总质量增加 |
| C.电池工作一段时间后,乙池的c(Zn2+)>c(SO42-) |
| D.阴、阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 |
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既不是氧化剂又不是还原剂。下列反应与Cl2+SO2+2H2O=H2SO4+2HCl相比较,水的作用完全相同的是
A.2H2O 2H2↑+O2↑ 2H2↑+O2↑ |
B.4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| C.2Na+2H2O=2NaOH+H2↑ | D.2Na2O2+2H2O=4NaOH+O2↑ |
已知Ba(AlO2)2可溶于水。下图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。则有关叙述不正确的是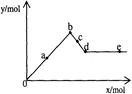
| A.0~b段沉淀的物质的量:Al(OH)3始终比BaSO4少 |
| B.c~d段溶液中离子的物质的量:AlO2―比Ba2+多 |
| C.a~d段沉淀的物质的量:BaSO4可能小于Al(OH)3 |
| D.d~e段溶液中离子的物质的量:Ba2+可能等于OH― |
设NA为阿伏伽德罗常数的值。下列说正确的是
| A.高温下,0.2molFe与足量稀硫酸反应反应,生成的H2分子数目为0.3NA |
| B.78g过氧化钠中含阴离子数为2 NA |
| C.C2H4和N2组成的42g混合气体中原子的个数为3 NA |
D.5NH4 NO3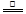 2HNO3+4N2↑+ 9H2O反应中,生成28gN2时,转移的电子数目为3.75NA 2HNO3+4N2↑+ 9H2O反应中,生成28gN2时,转移的电子数目为3.75NA |
下列化学反应的离子方程式书写不正确的是
| A.碳酸钙与盐酸的反应:CaCO3 +2H+ =Ca2++ CO2↑+ H2O |
| B.等物质的量的MgCl2、Ba(OH)2和HCl溶液混合: Mg2++2OH-=Mg(OH)2↓ |
| C.氧化铜与稀H2SO4反应:CuO+2H+ =Cu2+ + H2O |
| D.金属钠跟水反应: 2Na+2H2O=2Na++ 2OH- +H2↑ |
甲、乙两烧杯中各盛有100mL 3mol·L-1的盐酸和氢氧化钠溶液,向两烧杯中加入等质量的铝粉,反应结束后生成气体的体积比为甲:乙=1:2,则加入铝粉的质量为
| A.1.8g | B.3.6g | C.2.7g | D.5.4g |