现有下列化学仪器与用品:①玻璃棒 ②烧杯 ③托盘天平 ④量筒 ⑤药匙 ⑥胶头滴管 ⑦容量瓶 ⑧标签纸 ⑨细口试剂瓶
Ⅰ.称量:若需要配制500 mL 0.622 moL / L NaOH溶液,则应称取固体NaOH g;
Ⅱ.用以上称量后的NaOH固体配制溶液并备用:按配制溶液的过程顺序,从上述所给仪器和用品中选取需要的仪器(重复的不计),其编号排列是 ;
Ⅲ.配制过程中,应将固体NaOH溶解后并冷却至室温的溶液转移到 中,在转移时玻璃棒起 作用;在液面接近容量瓶刻度线 处,改用 定容。
Ⅳ.若实验中遇到下列情况,可能导致溶液浓度偏高的是 (填字母):
| A.固体氢氧化钠溶解时未冷却至室温,就开始转移、洗涤以及定容; |
| B.转移时不小心有少量溶液流到了容量瓶外; |
| C.定容时仰视容量瓶刻度线; |
| D.定容时加水超过了刻度线,马上用胶头滴管吸去多余的水。 |
E、配制好后,发现称量时所用的托盘天平的砝码生锈了
图Ⅰ是化学实验室中常用制备、干燥气体的部分仪器装置。某学校同学利用中学常用试剂及仪器设计下列实验。

 |
图Ⅰ
(1)图Ⅰ中仪器C的名称:_________________。
(2)同学甲利用图Ⅰ装置制备并收集干燥的NO2气体,请在方框内画出用集气瓶收集NO2的装置图。B中发生反应的离子方程式为_________。
(3)同学乙利用图Ⅰ装置通过称量反应前后C的质量,确定Na2CO3和NaCl固体混合物 中Na2CO3的质量。A中加入稀硫酸,B中加入Na2CO3和NaCl固体混合物,C中加入碱石灰。该装置存在较多缺陷,从而导致实验误差较大,请你说出其中的两点缺陷:
中Na2CO3的质量。A中加入稀硫酸,B中加入Na2CO3和NaCl固体混合物,C中加入碱石灰。该装置存在较多缺陷,从而导致实验误差较大,请你说出其中的两点缺陷:
①__________________;②___________________。
(4)同学丙利用图Ⅰ装置制取氨气和氧气的混合气体,并且利用图Ⅱ装置验证氨的某些性质。A中加入浓氨水,C中加入碱石灰,E内放置催化剂(铂石棉),按气流方向连接各仪器 a b c h。
a b c h。
图Ⅱ
①B内需加入固体试剂的名称为_________,B中能产生氨气和氧气混合气体的原因是_________。
②实验中观察到E内有红棕色气体出现,证明氨气具有_________性,E中发生反应的化学方程式为__________________。
10已知A、B、D、E均为中学化学常见单质及化合物,它们之间的转化关系如图所示(部分产物略去)
(1)若A和E均为单质且B物质为极性键形成的非极性分子。B的结构式为____。
(2)若A为可溶性强碱(MOH),E为同主族元素形成的常见非金属化合物,且该化合物中两种元素的质量比为1:1,试写出A到B的化学方程式______。
(3)若取B的溶液装于试管,向溶液中滴加KSCN溶液,无明显现象,再滴加稀盐酸,产生红色溶液,则用化学方程式表示工业制备E化学原理______;D的溶液中含有少量B,用离子方程式表示除杂方法_______。
有短周期元素A、B、C、D、E,已知:
①常温下,A元素的单质在空气或浓硫酸中,表面都能生成致密的氧化膜 ② B元素的原子序数比A元素大,其原子的次外层的电子数是最外层电子数的2倍
② B元素的原子序数比A元素大,其原子的次外层的电子数是最外层电子数的2倍
③ E与A同周期,C、D、E三种元素形成的单质或化合物可发生如下图所示的反应。
请用化学式或相应的符号回答下列问题:
(1)写出A元素最高价氧化物与NaOH溶液反应的离子方程式;
(2)B元素在元素周期表第周期第族;
B的固态氧化物的晶体类型是;
(3)D元素的原子结构示意图是:;
(4)B元素与E元素的最高价氧化物的水化物的酸性强弱>;
(5)请用化学方程式表示E元素的单质在工业上的一种重要用途:。
某化学兴趣小组参考工业制硝酸的化学原理,在实验室用下列各装置进行组合来制备硝酸并验证硝酸的性质(所给装置必须用到并且只能用一次,各装置中的试剂均足量。已知常温下CaCl2能吸收氨气)。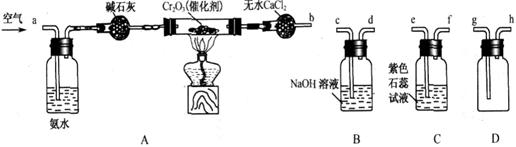
(1)装置的连接顺序为(用a、b、c、d等字母表示):b接( ),( )接( ),( )接( )。
(2)写出氨气催化氧化的化学方程式______________________。
(3)进行实验时,装置A中碱石灰的作用是_____________;D中的现象是_______________。
(4)能证明有硝酸生成的现象是__________________________________________。
(5)实验开始时,下列操作顺序最合理的是______________。
a.先加热A装置中的催化剂.再由导管a通入空气
b.先由导管a通人空气,再加热A装置中的催化剂
c.在由导管a通人空气的同时,加热A装置中的催化剂
下图所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置:请回答下列问题: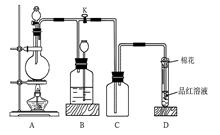
(1)在装置A中放入有关药品后,打开活塞K,将分液漏斗中的液体加入烧瓶中,关闭分液漏斗的活塞,点燃酒精灯,烧瓶中反应的化学方程式为__________。
(2)装置D中试管口放置的棉花中应浸有一种液体,这种液体是________,其作用是_________________。
(3)装置B的作用是贮存多余的二氧化硫和防止其污染环境,则B中应盛放的液体是(填写字母代号)________;
a.水 b.浓溴水;c.KMnO4酸性溶液d.NaHSO3饱和溶液
(4)收集二氧化硫完毕,应进行的操作为:________________________________。
(5)若用该套的A、B、C装置制备H2S,则B中应加入的最合理的液体是____________。