周末小瑾同学的妈妈做了一道红烧鱼鰾.细心的小瑾发现:妈妈在洗鱼鳔时,鱼鳔是浮在水面上的,用手撕鱼鳔时,水中有气泡冒出.鱼鳔中会有哪些气体呢?周一,小瑾和化学兴趣小组的同学来到实验室展开了实验探究.
【作出假设】甲乙两位同学分别对鱼鳔中的气体作出如下猜想:甲认为CO2,乙认为有H2O.
【查阅资料】
无水氯化钴试纸在实验室中常用来检验水的存在,原理:氯化钴遇水会发生水合反应,生成六水氯化钴.氯化钴是蓝色的而六水氯化钴是粉红色的.
手持技术是由数据采集器、传感器和配套的软件组成的定量采集和处理数据系统.手持技术可以广泛应用于理科实验中,可以方便而迅速的收集各类数据,如氧气含量,二氧化碳含量等.
【实验验证】
兴趣小组的同学用注射器抽取约60mL鱼鳔内的气体,注入澄清石灰水中.发现澄清石灰水 ,则甲的猜想成立.该反应的化学方程式是 .
兴趣小组的同学另取一只注射器抽取鱼鳔内的气体,将蓝色的氯化钴试纸放入注射器内,发现试纸变成粉红色,则乙的猜想
兴趣小组的小红同学又提问,气体内有没有氧气?大家在讨论后,制定了以下的实验方案验证鱼鳔内的气体是否有氧气?
| 实验操作 |
现象 |
结论 |
| 1用注射器抽取鱼鳔内的气体. 2用排水集气法收集注射器抽取的气体. 3将 伸入集气瓶中,观察现象. |
木条 熄灭 |
猜想一:不含氧气 猜想二:含少量氧气 猜想三:含有二氧化碳导致木条熄灭 |
【深入验证】但老师介绍了手持技术后,兴趣小组的同学用氧气传感器和二氧化碳传感器分别测得鱼鳔内氧气和二氧化碳的含量与如图:

【实验结论】小组同学一致认为猜想一 .
鱼鳔内CO2含量与空气中相比较,哪一个多? .
某化学小组围绕燃烧与灭火的主题开展了相关实验探究活动。请根据实验图示回答问题: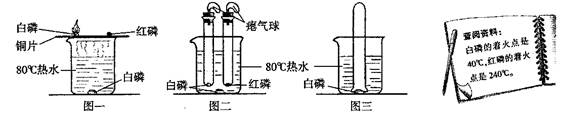
(1)图一实验中可观察到的现象是,改进后的装置(如图二)与图一相比,其优点是。
(2)将装有某气体的大试管口朝下垂直插入水中,使试管罩住白磷(如图三所示),结果观察到了“水火相容”的奇观,则大试管所装气体可能是,化学反应方程式为
。
(3)上述实验中可的出,可燃物燃烧的必备条件是,。
某化学兴趣小组利用下图装置探究制取气体的原理、方法。结合装置图,回答下列问题:
A B C D E
(1)写出图中标号仪器的名称:a,b。
(2)用氯酸钾和二氧化锰制取氧气时,可选用的发生装置是(填上图字母),可选用C装置收集氧气,其原因是。
(3)实验室常用氯化铵固体与碱石灰固体共热来制取一种易溶于水密度比空气小的氨气(NH3),应选择的制取装置是(填上图字母)。
(4)他们用碳酸钙与稀盐酸反应制取二氧化碳并验证其性质的实验装置(下图所示)。
装置A中发生的化学方程式为;装置B观察到澄清石灰水变浑浊,发生反
应的化学方程式为;装置C中观察到的现象是;
装置D中观察到下层蜡烛先熄灭,上层蜡烛后熄灭,说明二氧化碳的密度,它
不能燃烧,也不能支持燃烧。由此可知,二氧化碳在生活中可用于灭火。实验室用装置E
来收集二氧化碳时,二氧化碳应从(填“c端”或“d端”)通入。
化学课上,同学们做了人体呼出的气体使澄清石灰水变浑浊的实验后,对呼出的气体中主要成分及含量非常好奇,设计实验进行探究。
【提出问题】呼出的气体中有哪些主要成分,它们的含量是多少?
【查阅资料】①呼出的气体中仍含有 ;②
;②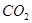 难溶于饱和
难溶于饱和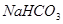 溶液;
溶液;
③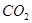 能被
能被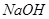 溶液吸收。
溶液吸收。
【猜想与实验】
猜想:呼出的气体中主要成分是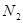 、
、 、
、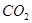 、水蒸气等。
、水蒸气等。
实验I:验证呼出的气体中含有水蒸气。
(1)实验操作如下图所示。
(2)观察到的现象为__________,根据该现象可以判断呼出的气体中含有水蒸气。
实验II:验证呼出的气体中含有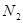 、
、 、
、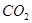 ,并测定其含量。
,并测定其含量。
同学们在老师的指导下设计了如下图所示装置(B是带刻度的量气装置)。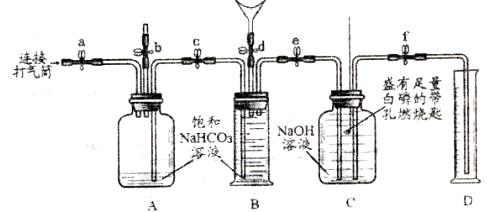
(1)实验记录
| 实验操作 |
主要实验现象 |
实验结论及解释 |
|
| ① |
检查装置的气密性。 向装置中加入药品。 关闭止水夹a~f |
 |
装置的气密性良好。 |
| ② |
打开b、c、d,向B中吹入一定量气体后关闭d,并冷却到室温。 |
B中液体进入到A中,B中液体减少500mL |
收集500mL气体。 |
| ③ |
关闭b, 打开a、e、f,用打气筒向A中缓缓充气,直到B中气体刚好全部排出。 打开a、e、f,用打气筒向A中缓缓充气,直到B中气体刚好全部排出。 |
________,D中液体为475mL。 |
反应的化学方程式为: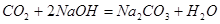 |
| ④ |
关闭e、f,用凸透镜聚光引燃白磷。 |
白磷燃烧,产生大量白烟,放出大量热。 |
呼出的气体中含有 。 。 |
| ⑤ |
待白磷熄灭并冷却到室温,打开f。 |
________,D中剩余液体为400mL。 |
呼出的气体中含有 。 。 |
(2)数据处理。根据(I)的实验记录,在下表空格中填上对应的数值。
呼出的气体中主要成分的含量
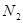 |
 |
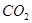 |
|
| 体积m/L |
|||
| 体积分数% |
【实验反思】
(1)该实验设计依据的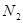 性质有__________(填字母序号)。
性质有__________(填字母序号)。
A. 难溶于水 B. 不能和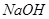 溶液反应
溶液反应
C. 无色无味的气体 D. 不能燃烧,也不支持燃烧
(2)实验II操作⑤中,若C中气体未完全冷却就打开f并读数,则所测 的体积分数__________(填“偏小”、“不变”、或“偏大”)。
的体积分数__________(填“偏小”、“不变”、或“偏大”)。
(6分) 对实验装置的改进与创新,能够提高学习化学的兴趣和能力。某兴趣小组同学进行了以下实验设计(注:图中部分固定装置省略,由分液漏斗滴入内置试管的液体量如图所示)。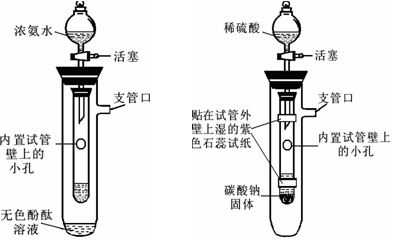
图1图2
⑴ 甲同学设计了如图1所示装置。向内置试管中滴入足量浓氨水,一段时间后,观察到酚酞溶液变为红色,此现象说明分子具有的性质是。
⑵ 乙同学设计了如图2所示装置。向内置试管中滴入足量稀硫酸,与碳酸钠充分反应,
化学方程式为:H2SO4 + Na2CO3 == Na2SO4 + H2O + CO2↑。
①通过仔细观察,两条试纸发生的变化是,
②乙同学从课本实验中知道,二氧化碳和水本身都不能使石蕊变色,因此他认为以上实验现象验证的二氧化碳的性质依次是。
③乙同学认为此装置还可以验证以下实验结论,请将实验操作填入下表:
| 实验结论 |
实验操作 |
| ①二氧化碳不能燃烧,也不支持燃烧 |
|
| ②二氧化碳不能使紫色石蕊变色 |
某课外活动小组同学用图12装置(固定装置未画出)测定含有杂质的镁带中镁单质的质量分数(杂质与酸接触不产生气体)。实验过程是:
①取一段镁带样品,准确称得其质量为0.040g。
②往量气管内装水至低于刻度“0”的位置。按图12所示(未装药品)装配好仪器。
③检查装置气密性。
④在试管中加入足量的稀硫酸,稍倾斜试管,将用水湿润的镁带小心贴在试管壁上,塞紧橡皮塞。
⑤调整量气管液面,使两边的液面保持同一水平,记录量气管中液面位置。
⑥把试管底部略为抬高,使镁带与稀硫酸接触完全反应。
⑦待冷却至室温后,再次记录量气管中液面位置。
⑧算出量气管中增加的气体体积为23.96mL。
已知:同温同压下,不同气体混合后体积等于混合前各气体体积之和。
请回答下列问题:
(1)能否用托盘天平称量0.040g镁带样品。(填“能”或“不能”)
(2)若不改变温度,如何用较简单的方法检查图12所示装置的气密性?
。
(3).经换算,该实验获得的氢气质量为 0.0020g。该镁带中单质镁的质量分数是多少?(要求写出计算过程)
0.0020g。该镁带中单质镁的质量分数是多少?(要求写出计算过程)
(4)实验过程⑦中再次记录量气管的液面位置时,试管中留有氢气,是否会影响实验最终结果(填“是”或“否”)。理由是。