镁条在空气中燃烧,不仅生成氧化镁、氮化镁,还有少量镁与二氧化碳反应生成另一种黑色固体单质和镁的氧化物。
(1)已知氮化镁中氮元素的化合价为 价,请你写出氮化镁的化学式 。
价,请你写出氮化镁的化学式 。
(2)写出镁与氧气反应的化学方程式 ;
(3)写出镁与二氧化碳反应的化学方程式 。
某种无色气体可能含有N2、CO、CO2、H2,使该混合气体依次通过紫色石蕊试液,没有变色。通过加热的CuO时有红色物质出现。再通过澄清石灰水时,石灰水无明显变化。则该混合气体中,一定含有,一定不含有,可能含有。
下图为某反应的微观示意图,请回答: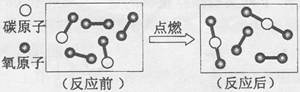
(1)反应后的物质是________(填“纯净物”、“混合物”)。
(2)该反应的化学方程式为______________
用化学方程式解释下列现象:
(1)小颖同学在探究二氧化碳性质时,将二氧化碳气体通入紫色石蕊试液,石蕊试液
很快变红色,原因是__________________________________;课后清洗仪器时,小颖发现变红的石蕊又变为紫色,原因是______________________。
(2)小颖还发现,盛过石灰水的试剂瓶内壁有一层白膜,形成这层白膜的原因是
;她用少量的稀盐酸将它清洗干净,原理是
。
| A.活性炭 | B.水 | C.干冰 | D.二氧化硫 E.氮气 F.一氧化碳选择正确答案的化学式填空: |
①形成酸雨的主要物质是。
②可用于人工降雨和舞台制造“云雾”效果的物质是;
③具有吸附性,净水器中常使用的物质是 。
④生活中常用的无色无臭透明液体是。
按要求填空:
⑴用化学符号表示:2个硫酸根离子,氢氧化铁中铁元素的化合价。
⑵下列微粒结构示意图中属于离子的是(填字母),共表示种元素。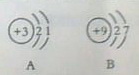
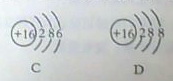
⑶地壳中含量最多的元素与最多的金属元素形成的化合物的化学式。