铁、铝、铜都是中学化学常见的金属.
(1)FeCl3溶液用于腐蚀印刷铜板,反应的离子方程式为: 。
(2)把SO2气体通入FeCl3溶液中,发生反应的离子方程式为: 。
(3)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。Fe(OH)3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为 。
(4)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
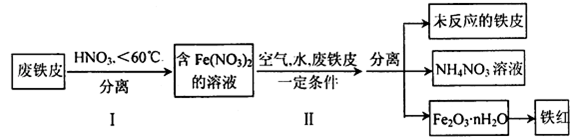
①过量的铁会与稀硝酸反应生成硝酸亚铁,请写出该反应的化学方程式:
②步骤Ⅱ中发生反应:4 Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3•nH2O+8HNO3,
4Fe+10HNO3="4" Fe(NO3)2+NH4NO3+3H2O,
第一个反应的还原剂是 ,第二个反应每生成1molNH4NO3,被还原的硝酸的物质的量是 。
③如何检验NH4NO3溶液中的NH4+离子,请描述操作 ,写出相关的离子反应方程式 。
④Fe(NO3)2在保存过程中容易被氧化,为防止被氧化常加入 。
⑤上述生产结束后,流程中氮元素最主要的存在形式为(填字母) 。
a、氮氧化物 b、硝酸铵 c、硝酸亚铁 d、硝酸
下表是元素周期表中的一部分,根据A~I在元素周期表中的位置,用元素符号或化学式回答下列问题:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
A |
|||||||
| 2 |
D |
E |
G |
I |
||||
| 3 |
B |
C |
F |
H |
(1)上表中,化学性质最不活泼的元素是_____,氧化性最强的单质是_____,还原性最强的是_____。
(2)最高价氧化物对应水化物的碱性最强的元素是________,酸性最强的元素是________。
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的是___________。
(4)请用电子式表示化合物BG的形成过程_________________________________。
(5)写出C的最高价氧化物对应水化物与B的最高价氧化物对应水化物反应的离子方程式:_______________________________________________________。
Ⅰ.依据氧化还原反应:2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)设计原电池,请回答下列问题:
(1)负极材料是____________;电解质溶液是____________;
(2)正极发生的电极反应为________________________;
(3)电解质溶液中Ag+向_________极移动。
Ⅱ.一定温度下在某定容容器中发生反应:2A(g)+3B(g)===2C(g),开始时,A的浓度为2 mol·L -1,B的浓度是4 mol·L-1,2 min后,A的浓度减少0.8 mol·L-1,则
(1)v(B)=___________,v(C)=____________。
(2)在2min末,C的浓度是____________,B的浓度是____________。
(16分)Ⅰ:中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
(1)有效“减碳”的手段之一是节能,下列制氢方法最节能的是_____
A.电解水制氢:2H2O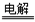 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O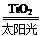 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O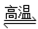 CO+ 3H2
CO+ 3H2
(2)CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入 1mol CO2和3mol H2,一定条件下反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。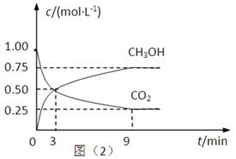
①从3 min到9 min,v(H2)=________mol·L-1·min-1。
②能说明上述反应达到平衡状态的是____________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
Ⅱ: 甲醇是一种可再生能源,具有广泛的开发和应用前景。
(3)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g) + 2H2(g) 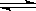 CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g) 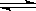 CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”)。
②已知反应Ⅰ的能量变化如图所示:由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。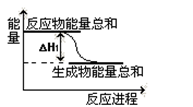
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L, 则CO的转化率为 。
(4)某实验小组依据甲醇燃烧的反应原理,设计如下图所示的电池装置。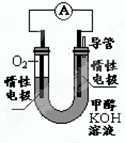
①该电池正极的电极反应为__________
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为________.
(12分)X、Y、Z、W、Q五种前四周期元素,原子序数依次增大。已知五种元素中只有一种为金属元素, XW2是通常呈液态的有机物,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为1,次外层电子数等于Y和W2 - 最外层电子数之和。根据以上信息回答下列问题:(用元素符号或化学式等化学用语回答)
(1)XW2的电子式为 。
(2)Z的气态氢化物在同主族元素气态氢化物中最高是因为 。
(3)Q在周期表中的位置 ,交警可以用H2SO4酸化的K2Cr2O7溶液检测驾驶员是否酒驾,其产物为乙酸、Q3+等。请写出此原理的离子方程式 。
(4)含W的两种元素种类相同的酸式铵盐溶液反应的离子方程式 。
(5)某种燃料电池一极通乙醇的最简单同系物蒸气,一极通Z2,以NaOH溶液为电解液。请写出该原电池负极的电极反应式 。
(2分)冶炼金属的三种常用方法是:①热分解法②热还原法③电解法。(填序号)
(1)冶炼铝用到的方法是 ;
(2)冶炼铁的常用方法是 。