某课外小组研究铝土矿中Al2O3的含量。查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:

(1)固体B的主要用途有(写出1条即可) 。
(2)第①步,向铝土矿中加入足量烧碱溶液,充分反应,发生反应的离子方程式是: ; 。
(3)第③步中,生成氢氧化铝的离子方程式是 。 若往A溶液中通入足量CO2,请写出可能发生反应的离子方程式______________。
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5 mol碳单质,转移1 mol电子,反应的化学方程式是_____________________。
(5)将实验过程中所得固体精确称量。课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,求该铝土矿中Al2O3的质量分数。(写出计算过程,计算结果保留一位小数)
为测定某亚硫酸钠样品的纯度,甲同学称取10.0g固体,进行如下实验: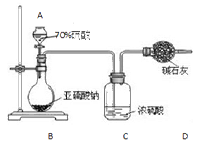
(1)实验仪器A的名称为。
(2)装置C中浓硫酸的作用是。
(3)若测得装置D中干燥管实验前后增重了4.8g,由此可计算出该样品中亚硫酸钠的纯度为。
(4)该实验方案存在明显缺陷,会使测定结果(填“偏高”或“偏低”)。为使结果准确,你的建议是。
(8分)阅读下列实验内容,根据题目要求回答问题。
实验室中有一未知浓度的稀盐酸,某学生用0.100mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。请完成下列填空:
| 实验编号 |
待测盐酸的体积(mL) |
NaOH溶液的浓度(mol·L-1) |
滴定完成时,NaOH溶液滴入的体积(mL) |
| 1 |
20.00 |
0.10 |
24.18 |
| 2 |
20.00 |
0.10 |
23.06 |
| 3 |
20.00 |
0.10 |
22.96 |
(1)滴定达到终点的标志是。
(2)根据上述数据,可计算出该盐酸的浓度约为(保留小数点后叁位)。
(3)若滴定结束时,碱式滴定管中的液面如图所示,终点读数为mL。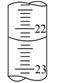
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有。
A.用酸式滴定管取20.00 mL待测盐酸,使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消失
蒸馏是实验室制备蒸馏水的常用方法。下图是实验室制取蒸馏水的常用装置。
(1)图中明显的错误是。
(2)仪器A的名称是,仪器B的名称是。
(3)实验时,A中除加入适量自来水外,还需加入少量,其作用是。
下列实验装置不能达到实验目的的是
(18分)某学习小组利用如图实验装置制备Cu(NH3)xSO4·H2O.并测量x值。
【Cu(NH3)xSO4·H2O制备】见图1
(1)A中发生的化学反应方程式为;B中观察到的现象是。
(2)C中CCl4的作用是 。
(3)欲从Cu(NH3)xSO4溶液中析出Cu(NH3)xSO4·H2O晶体,可加入试剂 。
【x值的测量】见图2
步骤一:检查装置气密性,称取0 .4690 g晶体[M = (178+17x)g/mol]于锥形瓶a中
步骤二:通过分液漏斗向锥形瓶a中滴加l0%NaOH溶液
步骤三:用0.5000 mol/L的NaOH标液滴定b中剩余HCI,消耗标液16. 00 mL
(4)步骤二的反应可理解为Cu(NH3)xSO4与NaOH在溶液中反应,其离子方程式为 。
【x值的计算与论证】
(5)计算:x = ,
该学习小组针对上述实验步骤,提出测量值(x)比理论值偏小的原因如下:
假设1:步骤一中用于称量的天平砝码腐蚀缺损;
假设2:步骤二中 (任写两点);
假设3 :步骤三中测定结束读数时,体积读数偏小。该假设(填“成立”或“不成立”),
针对假设l,你对实验的处理意见是。