(18分)某学习小组利用如图实验装置制备Cu(NH3)xSO4·H2O.并测量x值。
【Cu(NH3)xSO4·H2O制备】见图1
(1)A中发生的化学反应方程式为 ;B中观察到的现象是 。
(2)C中CCl4的作用是 。
(3)欲从Cu(NH3)xSO4溶液中析出Cu(NH3)xSO4·H2O晶体,可加入试剂 。
【x值的测量】见图2
步骤一:检查装置气密性,称取0 .4690 g晶体[M = (178+17x)g/mol]于锥形瓶a中
步骤二:通过分液漏斗向锥形瓶a中滴加l0%NaOH溶液
步骤三:用0.5000 mol/L的NaOH标液滴定b中剩余HCI,消耗标液16. 00 mL
(4)步骤二的反应可理解为Cu(NH3)xSO4与NaOH在溶液中反应,其离子方程式为 。
【x值的计算与论证】
(5)计算:x = ,
该学习小组针对上述实验步骤,提出测量值(x)比理论值偏小的原因如下:
假设1:步骤一中用于称量的天平砝码腐蚀缺损;
假设2:步骤二中 (任写两点);
假设3 :步骤三中测定结束读数时,体积读数偏小。该假设 (填“成立”或“不成立”),
针对假设l,你对实验的处理意见是 。
某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:
(1)除酒精灯和铁架台或三脚架外,①中所需的容器和夹持仪器分别为、
,①和⑥中都用到的仪器为;
(2)试剂x的化学式为;x与溶液B反应的离子方程式为;
(3)某同学取少量的溶液B向其中加入过量的某种强氧化剂,再滴加KSCN溶液,发现溶液变红色,放置一段时间后,溶液褪色,该同学猜测溶液褪色的原因是溶液中的SCN-被过量的氧化剂氧化所致。
现给出以下试剂:1.0 mol·L-1 硫酸、1.0 mol·L-1 NaOH溶液、0.1 mol·L-1 Fe2(SO4)3溶液、20%KSCN溶液、蒸馏水。请你设计合理实验验证乙同学的猜测是否合理。简要说明实验步骤和现象;
(4)某同学用实验制得的Fe2(SO4)3晶体配制0.1 mol·L-1的Fe2(SO4)3溶液,在称量出Fe2(SO4)3晶体后,溶解该晶体的具体操作为。
(13分) 下图是实验室中制备气体或验 证气体性质的装置图
证气体性质的装置图
(1)仪器a的名称是_________________。
(2)利用上图装置制备纯净、干燥的氯气。
①圆底烧瓶内发生反应的化学方程式为____________________________________。
②装置B中的溶液为_________________;烧杯中溶液的作用为____________________  。
。
③E装置发生反应的离子方程式为____________________________________。
(3)在上图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置完成如下实验:
实验1:证明SO2具有漂白性和还原性
实验2:证明碳元素的非金属性比硅元素的强
①B中为少量品红溶液,C中为少量酸性KMnO4溶液,则证明SO2具有漂白性的现象为__________________________________________。
②D中应加入足量的____________(填溶液名称),E中加入____________(填溶液名称),证明碳元素的非金属性比硅元素的强的现象为___________________________。
③为提高实验2的准确性,必须改进的装置为___________________。(填装置代号)
(10分)化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行探究:
Ⅰ、查阅资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
Ⅱ、牙膏样品中碳酸钙的定量测定:
利用下图所示装置(图中夹持仪器略去)进行实验,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。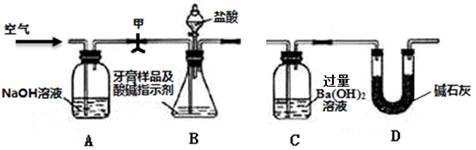
实验步骤:
如上图所示连接好装置,先检查装置的气密性;
准确称取牙膏样品的质量4.00g,并在各仪器中加入相应试剂;
打开弹簧夹甲,缓缓通入空气,然后接上C;
打开B的分液漏斗滴加盐酸反应,同时再次持续缓缓通入空气;
待B中不再产生气体后停止滴加盐酸;
将C中沉淀过滤、洗涤、干燥,得BaCO3;
称量BaCO3的质量为1.97g。
依据实验过程回答下列问题:
(1)步骤④通过空气的作用有:________________、_____________。
(2)步骤⑥中检验沉淀洗干净的方法是。
(3)本实验测定得到的样品中碳酸钙的质量分数为。若采取下列措施,对测定结果的准确度没有影响的是_____________(填标号)。
a.省略步骤③ b.滴加盐酸快一些
c.在B、C之间增添盛有饱和NaHCO3溶液的洗气装置
d. 多次实验,取平均值计算
(4)有同学认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以准确测定碳酸钙的质量分数。请你说明是否可以并简要说明理由。
(12分) 某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示实验装置(锌与浓硫酸共热时产生的气体为X,且该装置略去),试回答下列问题: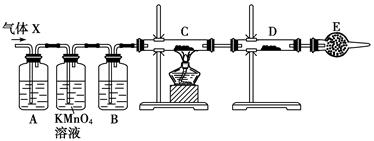
(1)上述反应中生成二氧化硫的化学方程式为_______________________________。
(2)乙同学认为还可能产生氢气的理由是_________________________________。
(3)丙同学在安装好装置后,必不可少的一步操作是_________________________。
(4)A中加入的试剂可能是,作用是_________________________________;
B中加入的试剂可能是,作用是___________________________________ ;
(5)可以证明气体X中含有氢气的实验现象是:
C中:,D中:________________________________________。
如果去掉装置B,还能否根据D中的现象判断气体X中有氢气? (填“能”或“不能”),原因是______________________________________
环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮: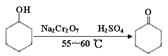
环己醇、环己酮和水的部分物理性质见下表:
| 物质 |
沸点(℃) |
密度(g·cm-3,20 ℃) |
溶解性 |
| 环己醇 |
161.1(97.8) |
0.9624 |
能溶于水 |
| 环己酮 |
155.6(95) |
0.9478 |
微溶于水 |
| 水 |
100.0 |
0.9982 |
括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
(1)酸性Na2Cr2O7溶液氧化环己醇反应的ΔH<0,反应剧烈将导致体系温度迅速上升,副反应增多。
实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧瓶中,在55~60 ℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100 ℃的馏分,得到主要含环己酮和水的混合物。
①酸性Na2Cr2O7溶液的加料方式为。
②蒸馏不能分离环己酮和水的原因是。
(2)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏,收集151~156 ℃馏分
b.过滤
c.在收集到的馏分中加NaCl固体至饱和,静置,分液
d.加入无水MgSO4固体,除去有机物中少量水
①上述操作的正确顺序是。(填字母)。
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需。
③在上述操作c中,加入NaCl固体的作用是。
(3)利用核磁共振氢谱可以鉴定制备的产物是否为环己酮,环己酮分子中有种不同化学环境的氢原子。