环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮: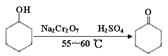
环己醇、环己酮和水的部分物理性质见下表:
| 物质 |
沸点(℃) |
密度(g·cm-3,20 ℃) |
溶解性 |
| 环己醇 |
161.1(97.8) |
0.9624 |
能溶于水 |
| 环己酮 |
155.6(95) |
0.9478 |
微溶于水 |
| 水 |
100.0 |
0.9982 |
|
括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
(1)酸性Na2Cr2O7溶液氧化环己醇反应的ΔH<0,反应剧烈将导致体系温度迅速上升,副反应增多。
实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧瓶中,在55~60 ℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100 ℃的馏分,得到主要含环己酮和水的混合物。
①酸性Na2Cr2O7溶液的加料方式为 。
②蒸馏不能分离环己酮和水的原因是 。
(2)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏,收集151~156 ℃馏分
b.过滤
c.在收集到的馏分中加NaCl固体至饱和,静置,分液
d.加入无水MgSO4固体,除去有机物中少量水
①上述操作的正确顺序是 。(填字母)。
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需 。
③在上述操作c中,加入NaCl固体的作用是 。
(3)利用核磁共振氢谱可以鉴定制备的产物是否为环己酮,环己酮分子中有 种不同化学环境的氢原子。
黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石
(主要成分为FeS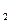 )进行如下实验探究。
)进行如下实验探究。
[实验一]:测定硫 元素的含量
元素的含量
I.将m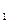 g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通人空气,高温灼烧石英管中的黄铁矿样品至反应完全得到红棕色固体和一种刺激性气味的气体。
g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通人空气,高温灼烧石英管中的黄铁矿样品至反应完全得到红棕色固体和一种刺激性气味的气体。
写出石英管中发生反应的化学方程式为: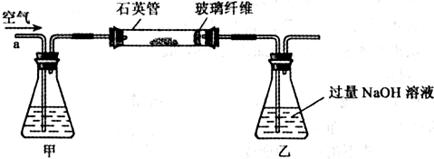
Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理: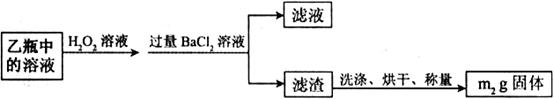
问题讨论:
(1)、I中,甲瓶内所盛试剂是____________溶液。乙瓶内发生反应的离子方程式
有________________________、________________________。
(2)、Ⅱ中,所加H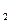 O
O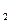 溶液需足量的理由是_______________________。
溶液需足量的理由是_______________________。
(3)、该黄铁矿石中硫元素的质量分数为____________________________ 。
[实验二]:设计以下实验方案测定铁元素的含量
问题讨论:
(4)、②中,若选用铁粉作还原剂。你认为合理吗?。
若不合理,会如何影响测量结果:_______________(若合理,此空不答)。
(5)、③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有________。
(6)、④中发生反应的离子方程式为
(6分)现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。
I、甲同学向1 mol·L-氯化铁溶液中加入少量的NaOH溶液;II、乙同学直接加热饱和FeCl3溶液;III、丙同学向25 ml沸水中逐滴加入1~2mL FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热。根据你的理论和实践试回答下列问题:
(1)其中操作最可能成功的同学是 ;他的操作中涉及到的化学反应方程式为
(2)设计最简单的办法确证有Fe(OH)3胶体生成,其操作及现象是:
则一定有Fe(OH)3胶体生成。
(3)丁同学利用所制得的Fe(OH)3胶体进行下列实验:
①将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明。
②向其中加入硫酸铝,可观察到的现象是。
下图是配制80mL2mol·L-1的NaOH的溶液过程示意图
(1)第(3)(4)(5)(6)步实验都涉及同一仪器,此仪器的名称为 。
。
(2)配制此溶液时,需称取NaOH固体的质量为 g。
(3)实验时,第(5)步操作向容量瓶中注入蒸馏水至刻度线时,改用胶头滴管小心加蒸馏水至溶液凹面与刻度线相切。如(3)步时未洗涤烧杯,所得溶液的物质的量浓度将(填“偏高”或“偏低”),如定容时俯视观察液面,物质的量浓度将__________。
(4)第(6)步操作后,发现液面下降,这时(填“需要”或“不需要”)再加水至刻度线。
某学生设计了如下实验方法分离NaCl和CaCl2两种固体混合物。
(1)B溶液是,加入过量B溶液的原因是,
反应的离子方程式是。
(2)经此实验方法分离得到的NaCl,经分析含有杂质,若要得到纯净的NaCl,还应补充实验操作,其反应的离子方程式是。
下图所示是分离混合物时常用的仪器及实验室硫酸试剂标签,回答下列问题: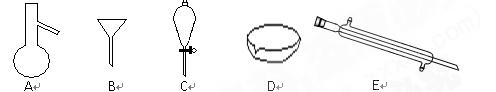
(1)写出仪器C、E的名称、
(2)分离以下混合物应该主要选用使用什么仪器?( 填字母符号)
填字母符号)
粗盐和泥沙:花生油和水:
(3)计算标签上硫酸的物质的量浓度为