(13分) 下图是实验室中制备气体或验 证气体性质的装置图
证气体性质的装置图
(1)仪器a的名称是_________________。
(2)利用上图装置制备纯净、干燥的氯气。
①圆底烧瓶内发生反应的化学方程式为____________________________________。
②装置B中的溶液为_________________;烧杯中溶液的作用为____________________  。
。
③E装置发生反应的离子方程式为____________________________________。
(3)在上图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置完成如下实验:
实验1:证明SO2具有漂白性和还原性
实验2:证明碳元素的非金属性比硅元素的强
①B中为少量品红溶液,C中为少量酸性KMnO4溶液,则证明SO2具有漂白性的现象为__________________________________________。
②D中应加入足量的____________(填溶液名称),E中加入____________(填溶液名称),证明碳元素的非金属性比硅元素的强的现象为___________________________。
③为提高实验2的准确性,必须改进的装置为___________________。(填装置代号)
(每空1分,共8分)实验室需要配制0.1 mol·L-1CuSO4溶液480 mL。
按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、______、________以及等质量的两片滤纸。
(2)计算,应选择下列正确________
| A.需要CuSO4 固体8g | B.需要CuSO4·5H2O晶体12.0 g |
| C.需要CuSO4·5H2O晶体12.5 g | D.需要CuSO4固体7.7 g |
(3)称量。所用砝码生锈则所配溶液的浓度会________(填“偏高”、“偏低”或“无影响”)。
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是_________________。
(5)转移、洗涤。在转移时应使用________引流,需要洗涤烧杯2~3次是为了______。
(6)定容,摇匀。
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,贴好标签,注明配制的时间、溶液名称及浓度。
(8)在配制过程中,某学生观察定容时液面情况如图所示,所配溶液的浓度会________(填“偏高”、“偏低”或“无影响”)。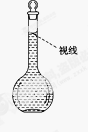
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。
请回答该实验中的问题。
(1)写出该反应的反应方程式:;并指明该氧化还原反应的还原剂是,氧化剂是。
(2)实验前必须对整套装置进行气密性检查,操作方法是。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是。
(4)干燥管中盛装是的物质是,作用是。
(5)试管中收集气体是,如果要在A处玻璃管处点燃该气体,则必须对该气体进行,操作方法是
(12分)某化学小组为了证明SO2和Cl2的漂白性,设计了如图所示的实验装置: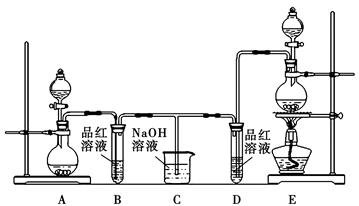
(1)他们制备Cl2依据的原理是:MnO2+4HCl(浓)  MnCl2+2H2O+Cl2↑,应选用上图A、E装置中的______________(填序号)制Cl2,反应中浓盐酸所表现出的性质是__________________。
MnCl2+2H2O+Cl2↑,应选用上图A、E装置中的______________(填序号)制Cl2,反应中浓盐酸所表现出的性质是__________________。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是________________________________。
(3)NaOH溶液分别与两种气体反应的离子方程式是
______________________________________________________
________________________________________________。
(4)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1∶1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是____________________________。
过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。
Ⅰ、测定过氧化氢的含量
请填写下列空白:
(1)移取10.00 mL密度为ρ g/mL的过氧化氢溶液至250mL ___________(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。
(3)滴定时,将高锰酸钾标准溶液注入(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为。
实验室用浓盐酸和MnO2制取并探究Cl2化学性质,装置图如下图所示:
(1)A是氯气发生装置,请完成反应的离子方程式为_________________________________。除了酒精灯和导管外,还用到的玻璃仪器有_______________。
(2)从C装置出来的气体中含有CO2和HCl,写出C中反应的化学方程式_____________________。
(3)同学们在实验中发现:若用稀盐酸代替浓盐酸与MnO2混合加热没有氯气生成。“影响氯气生成的原因是什么呢?”,同学们作了如下探究:
① 提出合理假设
假设1:Cl—的浓度对反应的影响;
假设2: