实验室用浓盐酸和MnO2制取并探究Cl2化学性质,装置图如下图所示:
(1)A是氯气发生装置,请完成反应的离子方程式为_________________________________。除了酒精灯和导管外,还用到的玻璃仪器有_______________。
(2)从C装置出来的气体中含有CO2和HCl,写出C中反应的化学方程式_____________________。
(3)同学们在实验中发现:若用稀盐酸代替浓盐酸与MnO2混合加热没有氯气生成。“影响氯气生成的原因是什么呢?”,同学们作了如下探究:
① 提出合理假设
假设1:Cl—的浓度对反应的影响;
假设2:
小明很喜欢化学实验课,今天要学习“探究铁及其化合物的氧化性或还原性”,现邀你一起走进他的化学课堂。
(1)课前老师布置了下列预习作业,请你一起完成:
①铁不同价态的物质各写一种(并标出铁元素的化合价):_____、_______、 ________。
②写出一个它们之间相互转化(含三种价态)的化学方程式:___________________ 。
(2)实验室提供的下列试剂:锌粒、铁粉、0.1 mol·L-1 FeCl3溶液、0.1 mol·L-1 FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性。
根据氧化还原反应的有关原理,小明说Fe2+既有还原性又有氧化性,为证实自己的假设,请你和小明一起设计实验方案,进行实验并描述实验现象,完成下列表格。
| 探究内容 |
实验方案 |
实验现象 |
| 探究Fe2+具有还原性 |
取少量0.1 mol·L-1 FeCl2溶液,加入足量__________后,再往溶液中加入少量__________ |
溶液变成血红色 |
| 探究Fe2+具有氧化性 |
取少量0.1 mol·L-1 FeCl2溶 液,加入_________充分 反应 |
溶液由浅绿色变无色 所发生反应离子方程式为________________ |
下图为配制0.2mol·L-1Na2CO3溶液250mL示意图。
回答下列问题:
(1)①中称得Na2CO3_____________g。
(2)玻璃棒在②、③两步中的作用分别是_____________、_____________。
(3)若出现如下情况,对所配溶液浓度有何影响?(填“偏高”、“偏低”或“无影响”)
A.某同学在第⑧步观察液面时俯视_____________;
B.没有进行操作步骤④和⑤_____________;
C.在第⑤步不慎有少量液体流到容量瓶外_____________。
Cl2和H2O2是高中阶段最常见的两种氧化剂,经查阅资料Cl2氧化能力强于H2O2,能将H2O2氧化。为了验证该结论,学生设计了如下图所示的实验装置进行实验(夹持装置略去)。圆底烧瓶A中的反应方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,请回答下列问题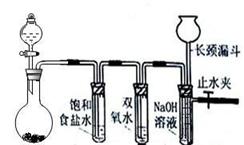
AB CD
(1)试管B中饱和食盐水的作用;
(2)试管C中加入5mL 30% 双氧水,发生反应的化学方程式____________________;
(3)试管D中充满10% NaOH溶液,NaOH溶液的作用是;
(4)将浓盐酸注入圆底烧瓶A,当装置中的空气基本排尽后关闭止水夹,反应一段时间后试管D中的现象为,试管D中的气体检验方法为__________________;
(5)有的同学对上述实验中试管D中气体来源产生质疑,你认为可能的来源有(用化学方程式表示),对于质疑可以采用对比实验来解决。
某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4 ·4H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
| 实验编号 |
初始 pH |
废水样品 体积/mL |
草酸溶液 体积/mL |
蒸馏水 体积/mL |
| ① |
4 |
10 |
30 |
|
| ② |
5 |
60 |
10 |
|
| ③ |
60 |
20 |
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示。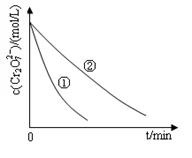
(2)实验①和②的结果表明_______________________________;
(3)该课题组队铁明矾[Al2Fe(SO4)4 ·4H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;假设二:;假设三:;……
(4)请你设计实验验证上述假设一,完成下表中内容。(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。(溶液中Cr2O72-的浓度可用仪器测定)
| 实验方案(不要求写具体操作过程) |
预期实验结果和结论 |
| 取_______________________________代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验 |
反应进行相同时间后 若溶液中的Cr2O72-浓度____________________________则假设一成立; 若溶液中的Cr2O72-浓度____________________________则假设一不成立; |
下图是实验室制备四氯化硅的装置示意图。已知:四氯化硅遇水极易反应。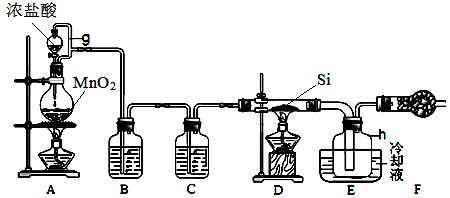
请回答下列问题:
(1)写出装置A中发生反应的化学方程式。
(2)装置A中g管的作用是。
干燥管F中碱石灰的作用是。
该组实验装置中存在的缺陷是。