下列叙述正确的是( )
| A.标准状况下,22.4L 的己烷含C-H键的数目为14NA |
| B.常温常压下,14g乙烯和甲基丙烯的混合物含原子数为3NA |
| C.78g苯含有C=C双键的数目为3NA |
| D.15g甲基含有的电子数7NA |
硫酸钾和硫酸铝的混合溶液,已知其中Al3+的浓度为0.4 mol/L,硫酸根离子浓度为0.7 mol/L,则K+的物质的量浓度为
| A.0.1 mol/L | B.0.15 mol/L | C.0.3 mol/L | D.0.2 mol/L |
根据下列化学方程式,判断有关物质的还原性强弱的顺序为
①I2+SO2+2H2O H2SO4+2HI;
H2SO4+2HI;
②2FeCl2+Cl2 2FeCl3;
2FeCl3;
③2FeCl3+2HI 2FeCl2+2HCl+I2
2FeCl2+2HCl+I2
| A.I->Fe2+>Cl->SO2 | B.Cl->Fe2+>SO2>I- |
| C.Fe2+>I->Cl->SO2 | D.SO2>I->Fe2+>Cl- |
厨房中的化学知识很多,下面是有关厨房中的常见操作或者常见现象,其中不属于氧化还原反
应的是
| A.烧菜用过的铁锅,经放置常出现红棕色斑迹 |
| B.用煤气灶燃烧沼气(主要成分为甲烷:CH4)为炒菜提供热量 |
| C.牛奶久置变质腐败 |
| D.用醋酸除去水垢[主要成分是CaCO3、Mg (OH)2] |
下列离子方程式改写成化学方程式正确的是
A.Cu2++2OH-=Cu(OH)2¯ CuCO3+2NaOH Cu(OH)2¯+Na2CO3 Cu(OH)2¯+Na2CO3 |
B.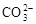 +2H+=CO2+H2O BaCO3+2HCl +2H+=CO2+H2O BaCO3+2HCl BaCl2+CO2+H2O BaCl2+CO2+H2O |
C.Ca2++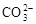 =CaCO3¯Ca(NO3)2+Na2CO3 =CaCO3¯Ca(NO3)2+Na2CO3 CaCO3¯+NaNO3 CaCO3¯+NaNO3 |
D.H++OH-=H2O Ba(OH)2+H2SO4  BaSO4 ¯+2H2O BaSO4 ¯+2H2O |
在2009年10月1日,新的饮用矿泉水强制性国家标准《饮用天然矿泉水》正式实施,其中“溴酸盐(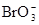 )”这一潜在致癌物质被做了严格限制。有关专家解释,矿泉水在开采过程中会含有少量溴化物(Br-),在后续的生产过程中经臭氧(O3)处理逐渐转化成溴酸盐。下列有关该转化过程的认识正确的是
)”这一潜在致癌物质被做了严格限制。有关专家解释,矿泉水在开采过程中会含有少量溴化物(Br-),在后续的生产过程中经臭氧(O3)处理逐渐转化成溴酸盐。下列有关该转化过程的认识正确的是
| A.该过程中溴化物(Br-)得到电子 |
B.该过程中臭氧(O3)是氧化剂,溴酸盐(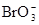 )是还原剂 )是还原剂 |
| C.该过程中溴元素被还原,氧元素被氧化 |
| D.该过程中溴元素发生氧化反应,氧元素发生还原反应 |