常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- |
| B.c(H+)/ c(OH-) = 1012的溶液中:NH4+、Al3+、NO3-、Cl- |
| C.由水电离的c(H+) = 1×10-13mol/L溶液中:K+、Na+、AlO2-、CO32- |
| D.含1.0mol·L-1Al3+的溶液中:Na+、HCO3﹣、SO42﹣、Mg2+ |
向足量H2SO4溶液中加入100mL 0.4 mol·L—1 Ba(OH)2溶液,放出的热量是5.12kJ。如果向足量Ba(OH)2溶液中加入100mL 0.4 mol·L—1 HCl溶液时,放出的热量为2.2kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为
| A.Ba2+(aq)+SO42—(aq)=BaSO4(s) △H=-2.92kJ·mol—1 |
| B.Ba2+(aq)+SO42—(aq)=BaSO4(s) △H=-0.72kJ·mol—1 |
| C.Ba2+(aq)+SO42—(aq)=BaSO4(s) △H=-73kJ·mol—1 |
| D.Ba2+(aq)+SO42—(aq)=BaSO4(s) △H=-18kJ·mol—1 |
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是
| A.由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+ |
| B.由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH-=AlO2-+2H2O |
| C.由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
| D.由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+ |
下列措施或事实能用勒沙特列原理解释的是
| A.在合成氨(正反应是放热)的反应中,升温有利于氨的合成 |
| B.钢铁在潮湿的空气中生锈 |
| C.H2、I2、HI平衡混合气加压后颜色变深 |
| D.新制的氯水在光照下颜色变浅 |
高温下,某反应达平衡,平衡常数K= 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
| A.该反应的焓变为正值 |
| B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,逆反应速率减小 |
D.该反应化学方程式为CO + H2O 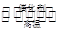 CO2+ H2 CO2+ H2 |
下图中A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,C为盛有稀硫酸的电解槽,e、f为Pt电极。接通电源后,发现d点显红色。下列有关说法正确的是
| A.电源A上的a极是正极 |
| B.d极上的电极反应方程式为2Cl--2e-=Cl2↑ |
| C.e、f极上产生的气体体积比为2:1 |
| D.C中溶液的pH增大 |