Na2S又称臭碱、硫化碱,是应用广泛的化工原料,也常用于吸收工业废气中的SO2。
完成下列填空:
(1)用离子方程式说明Na2S又称臭碱、硫化碱的原因___________________________。
(2)向AgCl悬浊液中滴加Na2S溶液,生成黑色沉淀,写出反应的离子方程式________。结合你所学习过的其它离子反应分析,离子互换反应进行的方向是_________________。向Na2S溶液中不断通入SO2,直至不再能吸收。其间看到溶液变浑浊,停止反应后溶液中含硫微粒为:S2O32-、HSO3-、H2SO3、HS-。
(3)反应过程中,溶液的pH逐渐_____________(填“变大”、“变小”),生成的沉淀是_____________;
(4)关于反应后得到的溶液,下列离子浓度关系正确的是___________。
a.c(Na+) = c(S2O32-) + 2 c(HSO3-) + 2c(H2SO3) + 2 c(HS-)
b.c(Na+) + c(H+) =" 2" c(S2O32-) + c(HSO3-) + c(HS-) + c(OH-)
c.c(Na+) =" 2" c(HS-)
用石油裂化和裂解过程得到的乙烯、丙烯来合成丙烯酸乙酯的路线如下:
有机物A + 有机物 C → CH2=CHCOOCH2CH3(丙烯酸乙酯)
根据以上材料和你所学的化学知识回答下列问题:
(1)由CH2=CH2制得有机物A的化学反应类型是:;
(2)丙烯醛[ CH2═CH CHO ]中含有的官能团:(填名称);
(3)A与C合成丙烯酸乙酯的化学反应方程式是:
_________________________________________________________________;
该反应的类型是反应。
目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:
请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是,写出在沉淀池的离子方程式。
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度,生产生石灰的主要原料来源于海洋中的。
(3)操作A是,操作B是。
(4)加入的足量试剂a是(填化学式)。
(6分)短周期A、B、C、D 4种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D与B属于同一族元素。
(1)元素:A为________, C为________,
(2)D的质子数和中子数相等,D的原子符号为:______________,它的最高价氧化物对应的水化物为:______________。
(3)用电子式表示C、D两元素形成化合物的过程:
_______________________________________________________________________。
某食用白醋是由醋酸与纯水配制而成,用中和滴定的方法准确测定其中醋酸的物质的量浓度。实验步骤:①配制500mL浓度约为0.1 mol·L-1的NaOH溶液;②用物质X的标准溶液准确测定该NaOH溶液的浓度(X与氢氧化钠按物质的量比1:1完全反应);③用已知准确浓度的NaOH溶液测定醋酸的浓度。
(1)称量所需的NaOH固体置于大烧杯中,加入500mL蒸馏水,搅拌溶解。该配制步骤__________(填“可行”或“不可行”)。
(2)称量时NaOH在空气中极易吸水,配制所得的NaOH溶液浓度通常比预期_____(填“小”或“大”),这是不能直接配制其标准溶液的原因。
(3)查阅白醋包装说明,醋酸含量约为6g/100mL,换算成物质的量浓度约为_____ mol·L-1,滴定前将白醋稀释_________(填“10”或“100”)倍。(已知醋酸的相对分子质量为60)
(4)稀释白醋时需要的仪器有烧杯、玻璃棒、滴管、酸式滴定管、___________。
(5)准确量取稀释后的白醋20.00mL,置于250mL锥形瓶中,加水30mL,再滴加酚酞指示剂,用上述NaOH标准溶液滴定至____________即为终点。重复滴定两次,平均消耗NaOH标准溶液V mL(NaOH溶液浓度为c mol·L-1)。
(6)原白醋中醋酸的物质的量浓度=____________ mol·L-1。
氨气是一种重要的化工原料,大量用于制造尿素、纯碱、铵态氮肥以及硝酸,在有机合成工业中制合成纤维、塑料、染料等。请回答下列问题:
(1)氨气是工业制备硝酸的重要原料,已知下列三个热化学方程式:
① N2 (g)+ 3H2 (g) 2NH3 (g)△H1
2NH3 (g)△H1
② 4NH3(g) +5O2 (g)= 4NO(g) +6H2O(l)△H2
③ N2 (g)+ O2 (g)= 2NO (g)△H
能否应用△H1和△H2表示△H?
若能用△H1和△H2表示△H,则写出△H=;若不能,说明理由:
。
(2)在相同的温度下,容积相等的两个恒容密闭容器(编号分别为a和b)中,一定量的氮气和氢气发生下列可逆反应:
N2(g) + 3H2(g)  2NH3(g)△H=-92.4 kJ/mol
2NH3(g)△H=-92.4 kJ/mol
实验测得反应起始时各物质的物质的量及平衡时放出的热量如下表:
| 容器编号 |
起始时各物质物质的量/mol |
平衡时反应 |
||
| N2 |
H2 |
NH3 |
||
| a |
1 |
3 |
0 |
23.1 |
| b |
2 |
6 |
0 |
未知(用E表示) |
下列说法正确的是(填序号)
①反应a和反应b的氢气转化率相同
②利用已知数据可以计算反应b的平衡常数
③利用已知数据可以计算反应b放出的能量E
④平衡时a、b两个反应的氨气体积分数为1:1
(3)温度为400℃、压强为30Mpa的情况下,密闭容器中发生氢气与氮气的合成氨反应:N2(g)+3H2(g)  2NH3(g)△H<0 。
2NH3(g)△H<0 。
氨气的物质的量[n(NH3)]和氢气的物质的量[n(H2)]随时间变化的关系如下图:
正反应速率最大的点是(选填a、b、c、d中的一个或几个),氮气的物质的量[n(N2)]相等的两点是(选填a、b、c、d中的两个);保持其他条件不变,将温度改为600℃,在上图中画出反应达到平衡的过程中氨气的变化曲线。
(4)工业合成氨用煤制备原料气氢气时,往往排放大量的二氧化碳。实际工业生成中可利用二氧化碳联合生产二甲醚(CH3OCH3),一定条件下,在容积固定的密闭设备中发生反应:
2CO2(g)+6H2(g)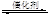 CH3OCH3(g)+3H2O(g)△H<0
CH3OCH3(g)+3H2O(g)△H<0
两个密闭恒容容器中在温度均为T且保持不变的情况下进行上述反应,一段时间后测得两个容器中有关数据及正逆反应速率关系如下表:
| 容器 |
c(CO2) /mol·L-1 |
c(H2) /mol·L-1 |
c(CH3OCH3) /mol·L-1 |
c(H2O) /mol·L-1 |
v (正)和v (逆)比较 |
| 容器I |
1.0×10-2 |
1.0×10-2 |
1.0×10-4 |
1.0×10-4 |
v (正)=v (逆) |
| 容器II |
2.0×10-2 |
1.0×10-2 |
1.0×10-4 |
2.0×10-4 |
容器I中的反应(选填“是”或“否”)达到平衡状态,该反应在温度为T时的平衡常数K=。表格内的空格处v(正)与v(逆)的大小关系是。