下图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是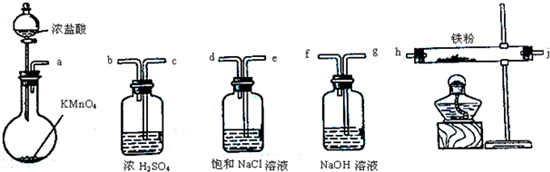
| A.a-b-c-d-e-f-g-h | B.a-c-b-d-e-h-i-f |
| C.a-d-e-c-b-h-i-g | D.a-e-d-c-b-h-i-g |
下列各装置中都盛有0.1 mol·L—1 的NaCl溶液,放置一定时间后,锌片的腐蚀速率由快到慢的顺序是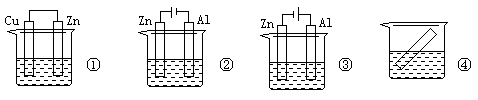
| A.③①④② | B.①②④③ | C.①②③④ | D.②①④③ |
在一定体积的密闭容器中放入3升气体R和5升气体Q,在一定条件下发生反应:2R(g)+5Q(g)
4X(g)+nY(g)。反应完全后,容器温度不变,混和气体的压强是原来的87.5%,则化学方程式中的n值是
| A.2 | B.3 | C.4 | D.5 |
在298K时,2SO2(g)+O2(g)  2SO3(g) ΔH=-197 kJ·mol-1,在相同的温度下,向密闭真空容器中通入2molSO2和1molO2,达到平衡时放出热量Q1; 向另一个同体积的密闭真空容器中通入1molSO2和0.5molO2,达到平衡时放出热量Q2,则下列关系中正确的是
2SO3(g) ΔH=-197 kJ·mol-1,在相同的温度下,向密闭真空容器中通入2molSO2和1molO2,达到平衡时放出热量Q1; 向另一个同体积的密闭真空容器中通入1molSO2和0.5molO2,达到平衡时放出热量Q2,则下列关系中正确的是
A.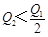 |
B.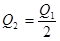 |
C.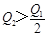 |
D.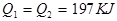 |
一定条件下,对于可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c
2Z(g),若X、Y、Z的起始浓度分别为c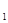 、c
、c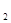 、c
、c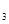 (均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是
(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是
A.c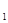 :c :c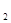 =1:2 =1:2 |
| B.平衡时,Y和Z的生成速率之比为2:3 |
| C.X、Y的转化率相等 |
D.c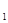 的取值范围为0.04 mol/L<c 的取值范围为0.04 mol/L<c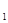 <0.14 mol/L <0.14 mol/L |
在N2 (g)+ 3H2(g) 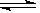 2 NH3 (g)的平衡体系中,其他条件不变,增加氮气的浓度,下列判断正确的是
2 NH3 (g)的平衡体系中,其他条件不变,增加氮气的浓度,下列判断正确的是
| A.氮气的转化率增大 |
| B.氢气的转化率增大 |
| C.氨气在平衡混合气体中的百分含量一定增大 |
| D.氨气的分解速率大于氨气的生成速率 |