某品牌糖衣片补血剂,除去糖衣后显淡蓝绿色,主要成分是硫酸亚铁,不含其它铁的化合物。某研究性学习小组为测定该补血剂中硫酸亚铁的含量进行了以下探究:
请回答下列问题:
Ⅰ.(1)实验时用10mol•L-1的浓硫酸,配制100mL 1mol•L-1 H2SO4溶液,所需浓硫酸的体积为_________mL;
(2)下列操作中,容量瓶所具备的功能有(填序号);
A.配制一定体积准确浓度的标准溶液
B.长期贮存溶液
C.常用来代替量筒量取一定体积的液体
D.用来溶解固体溶质
(3)在下列配制过程示意图中,有错误的是__________(填写序号);
(4)下列说法正确的__________
A.洗涤烧杯2~3次,并将洗涤液移入容量瓶以减少误差
B.某同学将浓硫酸稀释后未冷却至室温便将溶液转移至容量瓶,所配溶液浓度会偏低
C.定容时仰视观察,所配溶液浓度会偏低
Ⅱ.(1)步骤②加入过量H2O2后,溶液中主要存在的金属阳离子是_____________;
(2)从红褐色的悬浊液到最后的称量,其过程中所需的基本操作为:
a.__________,b.洗涤,c.灼烧,d.冷却
(3)若称得固体的质量为ag,则每片补血剂中含硫酸亚铁的质量为__________g。
如图在试管A中先加入2mL的甲,并在摇动下缓缓加入2mL乙,充分摇匀,冷却后再加入丙,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管B中加入5ml丁溶液,按图连接好装置,用酒精灯对试管A小火加热3~5min后,改用大火加热,当观察到B试管中有明显现象时停止实验。试回答:
(1)写出下列物质的化学式(不用指出浓度)
甲乙
丙丁
(2)甲物质所含官能团的名称为
(3)写出试管A中发生反应的化学方程式
(4)若用18O标记乙醇中的氧元素,则18O会出现在哪种生成物中?
(5)试管甲中加入浓硫酸的主要目的是
(6)B中长导管不宜伸入试管的溶液中,原因是
(7)B中使用丁溶液的作用是
(17分)某课外小组设计的实验室制取乙酸乙酯的装置如图14-2所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。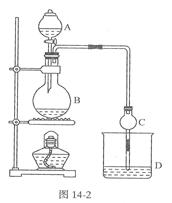
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6 C2H50H
②有关有机物的沸点:
| 试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
| 沸点/℃ |
34.7 |
78.5 |
118 |
77.1 |
第5页
请回答:
(1)浓硫酸的作用是;若用同位素180示踪法确定反应产物水分子中氧原子的提供者,写出能表示180位置的化学方程式:。
(2)球形干燥管C的作用是。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示);反应结束震荡静止后D中的现象是.
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出;再加入(此空从下列选项中选择),然后进行蒸馏,收集77℃左右的馏分,以得较纯净的乙酸乙酯。
| A.五氧化二磷 | B.碱石灰 | C.无水硫酸钠 | D.生石灰 |
(4)有同学拟通过红外光谱仪鉴定所得产物中是否含有“-CH2CH3”,来确定副产物中存在乙醚。请你对该同学的观点进行评价:。
(8分)溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物,根据下面的探究实验回答问题。
(1)用下图所示装置进行实验:该实验的目的是;
试管II中观察到的现象是;
装置I的作用是。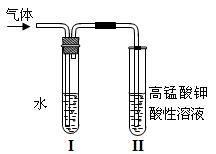
(2)若用另一实验来达到上述实验的目的,实验方案依据的反应原理是
_____(用化学方程式表示)。
某学生设计了一个制取氢氧化亚铁的最佳实验方案,实验装置见图,请分析实验过程:
⑴在B试管中加入NaOH溶液后加热煮沸1—2分
钟立即加入2mL液体石蜡,该操作目的是_______________ ________。
⑵在具支试管A中加入稀H2SO4溶液和略微过量的铁粉,分析为什么铁粉过量_________________________。
⑶连接好导管,同时打开活塞,当铁粉与稀硫酸反应平稳时,关闭活塞,这时A试管中的现象为____________________,原因是_______。B试管中现象为__。
Ⅰ.将刮去氧化膜的镁片投入沸水中,反应的化学方程式为 。
Ⅱ.若用灼热的镁粉与水蒸气反应,则在生成H2的同时还可能得到氧化镁粉未。为实现这一反应并收集一瓶H2,某课外活动小组设计了如图所示的装置。
(1)实验开始时,应先点燃 (填“A”或“B”)处的酒精灯, 等观察到 ,再点燃另一酒精灯。这样做的目的是 。
等观察到 ,再点燃另一酒精灯。这样做的目的是 。
(2)若将装置D与干燥管相连,则所连导管口应为 (填“m”或“n”),这种方法叫 (填“向上”、“向下”)排气法
(3)小试管C的作用是 。
(4)装置E的作用是检验集气瓶中是否收集满了H2,则检验的操作和需要观察的现象是 。
(5)反 应一段时间后,B装置玻璃管中可能残留的固体物质除MgO外,还可能M
应一段时间后,B装置玻璃管中可能残留的固体物质除MgO外,还可能M g和Mg(OH)2任选其中一种,设计实验证明它的存在,简要写出主要操作.所用试剂.现象及结论。
g和Mg(OH)2任选其中一种,设计实验证明它的存在,简要写出主要操作.所用试剂.现象及结论。