有人设计了如图所示的实验装置来探究钠与水反应(铁架台等仪器已略)。实验前在橡胶塞下端打一个小孔穴,将一大小适中的钠块固定于针头下端,向上抽动针头使钠块藏于孔穴内.在玻璃反应管内装入适量水(使钠块不与水接触).实验时,拔去橡胶乳头,按住橡胶塞,将针头缓缓向上拔起使钠与水接触,反应管内的液体被产生的气体压出,流入置于下方的烧杯中,气体则被收集在反应管内。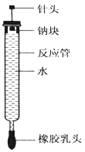
(1)钠与水反应的离子方程式为______________________;
(2)实验中“钠块熔化为闪亮的小球”说明____________________;向烧杯中的溶液中滴加________________,溶液变红,说明钠与水反应生成碱性物质;
(3)如果实验前加入反应管内水的体积为amL,欲使水最终全部被排出,则所取金属钠的质量至少为_______ g(设当时实验条件下气体摩尔体积为VmL/mol)。
研究性学习小组进行SO2的制备及性质探究实验。 (1)根据反应Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2+H2O,制备SO2气体。
(1)根据反应Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2+H2O,制备SO2气体。 ①用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图。
①用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图。
 ②实验过程中,使用分液漏斗滴加浓硫酸的操作是 。
②实验过程中,使用分液漏斗滴加浓硫酸的操作是 。 (2)将SO2气体分别通入下列溶液中:
(2)将SO2气体分别通入下列溶液中: ①品红溶液,现象是 ;
①品红溶液,现象是 ; ②溴水溶液,现象是 ;
②溴水溶液,现象是 ; ③硫化钠溶液,现象是 。
③硫化钠溶液,现象是 。 (3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)。
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)。 ①原因 ,验证方法 。
①原因 ,验证方法 。 ②原因 ,验证方法 。
②原因 ,验证方法 。 ③原因 ,验证方法 。
③原因 ,验证方法 。
某学生课外活动小组利用右图所示装置分别做如下实验:
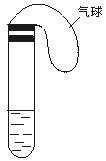
 (1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是 溶液;加热时溶液由红色逐渐变浅的原因是 。
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是 溶液;加热时溶液由红色逐渐变浅的原因是 。 (2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是 溶液;加热时溶液由无色变为红色的原因是 。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是 溶液;加热时溶液由无色变为红色的原因是 。
某无色溶液中只可能含有①Na+ 、②Ba2 +、③Cl-、④Br-、⑤SO32-、⑥SO42-离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
| 步骤 |
操作 |
现象 |
| (1) |
用pH试纸检验 |
溶液的pH大于7 |
| (2) |
向溶液中滴加氯水,再加入CCl4振荡,静置 |
CCl4层呈橙色 |
| (3) |
向所得水溶液中加入Ba(NO3)2溶液和稀HNO3 |
有白色沉淀产生 |
| (4) |
过滤,向滤液中加入AgNO3溶液和稀HNO3 |
有白色沉淀产生 |
下列结论正确的是()
| A.肯定含有的离子是①④⑤ | B.肯定没有的离子是②⑤ |
C.可能含有的离子是①⑥ | D.不能确定的离子是③⑥ |
对某酸性溶液(可能含有Br-,SO42-,H2SO3,NH 4+)分别进行如下实验: ①加热时放出的气体可以使品红溶液褪色;
①加热时放出的气体可以使品红溶液褪色; ②加碱调至碱性后,加热时放出的气体可以使湿润的红色石蕊试纸变蓝;
②加碱调至碱性后,加热时放出的气体可以使湿润的红色石蕊试纸变蓝; ③加入氯水时,溶液略显黄色,再加入溶液,产生的白色沉淀不溶于稀硝酸。
③加入氯水时,溶液略显黄色,再加入溶液,产生的白色沉淀不溶于稀硝酸。 对于下列物质不能确认其在原溶液中是否存在的是()
对于下列物质不能确认其在原溶液中是否存在的是()
A. |
B. |
C. |
D. |
检验二氧化硫气体中有无二氧化碳气体,应采取的方法是()
| A.通过澄清石灰水 | B.先通过足量小苏打溶液,再通过石灰水 |
C.先通过足量酸性高锰酸钾溶液,再通过澄清石灰水 | D.通过品红溶液 |