将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图。(横坐标体积单位是mL,纵坐标质量单位是g)
求:
(1)加入NaOH溶液0--20mL过程中反应的离子方程式为____________________;沉淀中Al(OH)3的质量为____________g。
(2)合金中Mg的质量为___________;所用HCl的物质的量浓度为___________mol/L。
咖啡酸具有止血功效,存在于多种中药中,其结构简式为:
(1)写出咖啡酸中两种含氧官能团的名称:______、________。
(2)根据咖啡酸的结构,列举咖啡酸可以发生的三种反应类型:________、________、________。
(3)蜂胶的分子式为C17H16O4,在一定条件下可水解生成咖啡酸和一种醇A,则醇A的分子式为________。
(4)已知醇A含有苯环,且分子结构中无甲基,写出醇A在一定条件下与乙酸反应的化学方程式:
________________________________________________________________________
________________________________________________________________________。
含苯酚的工业废水的处理流程如下图所示:
(1)上述流程图设备Ⅰ中进行的是________操作(填写操作名称)。实验室里这一步操作可以用________(填仪器名称)进行。
(2)由设备Ⅱ进入设备Ⅲ的物质A是________。由设备Ⅲ进入设备Ⅳ的物质B是________。
(3)在设备Ⅲ中发生反应的化学方程式为___________________________
________________________________________________________________________。
(4)在设备Ⅳ中,物质B 的水溶液和CaO反应后,产物是NaOH、H2O和________________。通过______________(填操作名称)操作,可以使产物相互分离。
(5)图中,能循环使用的物质是:_______、_______、C6H6和CaO。
一辆载有近30吨苯酚的槽罐车途经某市时发生侧翻,约有10吨的苯酚泄漏,空气中弥漫着浓烈的酸臭气味,对当地居民生活造成很大威胁,苯酚是一种有毒的物质,对皮肤、黏膜有强烈的腐蚀作用。
(1)苯酚的化学式为(C6H6O)属于________(填“有机物”或“无机物”)。
(2)现场救护人员应佩戴呼吸器,穿好防化服的原因是__________________________________。
(3)你认为下列对事故的处理方法合理的是( )
①用水进行冲洗或用泥土填埋苯酚
②挖隔离沟、铺薄膜防止扩散并回收泄漏的苯酚
③随时监测附近水源、土壤中的苯酚含量
(4)用木屑吸附残余的苯酚,然后燃烧处理,写出苯酚完全燃烧的化学方程式______________。
有A、B、C三种烃的衍生物,相互转化关系如下:1,2二溴乙烷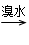 气体
气体 A
A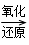 B
B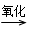 C,其中B可发生银镜反应,C跟石灰石反应产生使石灰水变浑浊的气体。A、B、C的结构简式和名称依次是:____________________、__________________________、______________________。
C,其中B可发生银镜反应,C跟石灰石反应产生使石灰水变浑浊的气体。A、B、C的结构简式和名称依次是:____________________、__________________________、______________________。
A→B的化学方程式为:
________________________________________________________________________。
B→C的化学方程式为:
________________________________________________________________________。
B→A的化学方程式为:
________________________________________________________________________。
吕布兰法是一种制造纯碱的方法。1789年,法国奥尔良地区封建主公爵的侍从医生吕布兰(N.Leblanc,1742—1806)成功地创造出来的,1791年获得专利,建立起日产250~300 kg的碱厂。吕布兰制碱法所用的原料除食盐外,还有硫酸、木炭和石灰石。。请回答下列问题:
(1)吕布兰芳是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取,结晶而制得纯碱。
①食盐和浓硫酸反应的化学方程式为___ ________;
②硫酸钠和焦炭、石灰石反应的化学方程式为___________(已知产物之一为CaS);
③由于吕布兰芳法的副产物氯化氢排入大气,对环境有污染;1866年生产工作者迪肯(H.Deacon,1822—1876)和胡尔特(F.Hurter,1844—1896)将此氯化氢气体与预热的空气混合通过铜和锰的氧化物,最后又将反应产物通入石灰水吸收。请根据上述信息写出相应的化学方程式:
(2)氨碱法的工艺如下图所示,得到的碳酸氢钠经煅烧生成纯碱。
图中的中间产物C是______,D_______。(写化学式);
②装置甲、乙中发生反应的化学方程式为_______;
(3)联合制碱法对氨碱法的改进,其优点是______________
(4)工业制法获得的纯碱中常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数.将样品mg溶于水,加入过量BaCl2溶液,充分过滤,洗涤沉淀,并低温烘干、冷却称量所得固体ng,样品中NaCl的质量分数的数学表达式为: