用化学方程式解释下列问题
(1)久置氯水不能使有色布条褪色:_____________________________;
(2)被SO2漂白的品红溶液中通入氯气后先复色再褪色,解释“复色”的原因:______________;
(3)氢氟酸不能用玻璃瓶储存:_________________________________;
(4)饱和亚硫酸钠溶液能吸收SO2________________________________;
(5)氯化铁溶液能吸收硫化氢___________________________________。
2009年《自然》杂志报道了我国科学家通过测量SiO2中26Al和10Be两种元素的比例确定“北京人”年龄的研究结果,这种测量方法叫“铝铍测年法”。请完成下列填空:
(1)10Be和9Be。(填序号)
a.具有相同的化学性质 b.Be 元素的近似相对原子质量是9.5
c.具有相同的中子数 d.通过化学变化可以实现10Be和9Be间的相互转化
(2)研究表明26Al可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是。(填序号)
a.比较这两种元素的单质的硬度和熔点
b.将空气中放置已久的这两种元素的单质分别和热水作用
c.将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液
d.在氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液
(3)目前还有一种测量方法叫“钾氩测年法”。写出和Ar核外电子排布相同的阴离子的半径由大到小的顺序(用化学符号表示);其中一种离子与钾相邻元素的离子所形成的化合物可用做干操剂,此化合物的电子式为。
已知:稀溶液中,强酸与强碱反应中和热的数值为57.3kJ/mol。
(1)用0.1molBa(OH)2配成的稀溶液跟足量的稀硝酸反应,放出______kJ的热量
(2)1L0.1mol/LNaOH溶液分别与①醋酸溶液②浓硫酸③稀硝酸恰好反应时,放出的热量分别为Q1、Q2、Q3(单位:kJ),则它们由大到小的顺序是_________________________
据图回答下列问题:
Ⅰ、(1)若烧杯中溶液为稀硫酸,则观察到的现象是______________________
负极反应式为:_________________________________________________。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为________(填Mg或Al),总反应化学方程式为
______________________________________________________________。
Ⅱ、由Al、Cu、浓硝酸组成原电池,其正极的电极反应式为
Ⅲ、(1)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇: CO(g)+2H2(g)  CH3OH(g)。
CH3OH(g)。
分析该反应并回答下列问题:下列各项中,不能够说明该反应已达到平衡的是________(填序号)。
a.恒温、恒容条件下,混合气体的平均相对分子质量不变
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗2 mol H2,同时生成1 mol CH3OH
(2)2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如下图所示。
①该电池工作时,b口通入的物质为________________,
c口通入的物质为________________。
②该电池负极的电极反应式为:_______
③工作一段时间后,当6.4 g甲醇完全反应生成CO2时,
有______________NA个电子转移。
Ⅰ、有下列五种烃:① ②
②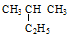 ③乙烷 ④戊烷 ⑤
③乙烷 ④戊烷 ⑤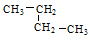 ,其中互为同分异构体的是(填序号),②与⑤之间的关系为,
,其中互为同分异构体的是(填序号),②与⑤之间的关系为,
②③④⑤四种物质按它们的沸点由高到低的顺序排列正确的是(填序号)
Ⅱ、某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A在一定条件下可发生如图所示的转化,请回答下列问题: 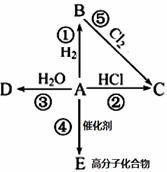
(1)写出A的电子式,E的结构简式为
(2)写出下列反应化学方程式,并注明③⑤反应类型
② _____________________________________________
③ _____________________ ,反应类型________;
⑤ _____________________ ,反应类型________;
(3)除去B中混有的少量杂质A,所用的试剂为
正丁醚常用作有机反应的溶剂。实验室制备正丁醚的主要实验装置如下图:
反应物和产物的相关数据如下
合成正丁醚的步骤:
①将6 mL浓硫酸和37 g正丁醇,按一定顺序添加到A中,并加几粒沸石。
②加热A中反应液,迅速升温至135℃,维持反应一段时间。分离提纯:
③待A中液体冷却后将其缓慢倒入盛有70 mL水的分液漏斗中,振摇后静置,分液得粗产物。
④粗产物依次用40 mL水、20 mL NaOH溶液和40 mL水洗涤,分液后加入约3 g无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11 g。
请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为______________________________。
写出步骤②中制备正丁醚的化学方程式______________________________。
(2)加热A前,需先从__________(填“a”或“b”)口向B中通入水。
(3)步骤③的目的是初步洗去,振摇后静置,粗产物应从分液漏斗的(填“上”或“下”)口分离出。
(4)步骤④中最后一次水洗的目的为______________________________。
(5)步骤⑤中,加热蒸馏时应收集__________(填选项字母)左右的馏分。
a.100℃ b. 117℃ c. 135℃ d.142℃
(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A。分水器中上层液体的主要成分为__________,下层液体的主要成分为__________。(填物质名称)
(7)本实验中,正丁醚的产率为__________。