使5.6LCO2气体迅速通过Na2O2固体后得到4.48L气体(标准状况下),这4.48L气体的质量为( )
| A.8.2g | B.8.8g | C.6.4g | D.6.2g |
欲在金属表面镀银,应把镀件挂在电镀池的阴极。下列各组中,选用的阳极金属和电镀液均正确的是
| A.Ag和AgCl溶液 | B.Ag和AgNO3溶液 |
| C.Fe和AgNO3溶液 | D.Pt和Ag2SO4溶液 |
在Na2S溶液中c(Na+)与c(S2-)的比值是
| A.2 | B.小于2 | C.大于2 | D.1/2 |
将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是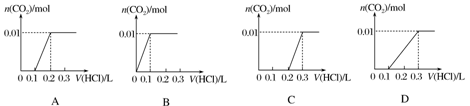
微粒检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1g样品加热,其质量变为w2g,则该样品的纯度(质量分数)是
A. |
B. |
C. |
D.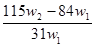 |
将4.34 g Na、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到672 mL混合气体,将混合气体通电后恰好完全反应,则Na、Na2O、Na2O2的物质的量之比为
| A.4∶3∶2 | B.1∶2∶1 | C.1∶1∶2 | D.1∶1∶1 |