下列关于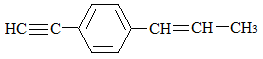 的说法中正确的是( )
的说法中正确的是( )
| A.所有碳原子都在同一平面上 |
| B.最多只可能有9个碳原子在同一平面上 |
| C.只可能有5个碳原子在同一直线上 |
| D.可能有6个碳原子在同一直线上 |
下表为六种短周期元素的部分性质:
| 元素代号 |
X |
Y |
Z |
Q |
R |
T |
| 原子半径/10-10m |
0.77 |
0.74 |
0.75 |
1.17 |
0.99 |
1.10 |
| 主要化合价 |
+4、-4 |
-2 |
+5、-3 |
+4、-4 |
+7、-1 |
+5、-3 |
下列有关说法错误的是( )
A.X与Y可以形成阴离子XY32-
B.Z的氢化物的沸点比T的氢化物的沸点高
C.元素R的氧化物对应的水化物一定为强酸
D.由X形成的化合物XY2和XR4,其中XR4的沸点高
甲~庚元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是()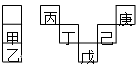
| A.丙与戊的原子序数相差27 |
| B.气态氢化物的稳定性:庚<己<戊 |
| C.丁的最高价氧化物可用于制造光导纤维 |
| D.常温下,甲和乙的单质均能与水剧烈反应 |
W、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18。下列说法正确的是( )
| A.单质的沸点:W>X | B.氧化物的水化物的酸性:Y<Z |
| C.阴离子的还原性:Y>Z | D.X与Y不能存在于同一离子化合物中 |
设NA为阿伏加德罗常数的值,下列叙述正确的是()
| A.标准状况下,22.4LNO与0.5molO2充分反应,最后得到NA个NO2分子 |
| B.1.0L 0.5mol/L的NaAlO2水溶液中含有氧原子数为NA |
| C.常温常压下,14 g的C2H4和C4H8混合气体中含有的原子数为3NA |
| D.某密闭容器盛有0.2molSO2和0.1molO2,在一定条件下充分反应,转移电子的数目为0.4NA |
在甲、乙两个体积不同的密闭容器中,分别充入质量相同的CO、CO2气体时,两容器的温度和压强均相同,则下列说法正确的是( )
| A.充入的CO分子数比CO2分子数少 | B.甲容器的体积比乙容器的体积小 |
| C.CO的摩尔体积比CO2的摩尔体积小 | D.甲中CO的密度比乙中CO2的密度小 |