为了证明在实验室制备得到的Cl2中会混有HCl,甲同学设计了如下图所示的实验装置,按要求回答下列问题。

(1)请根据甲同学的示意图,所需实验装置从左至右的连接顺序为:装置②→ ;
(2)装置②中主要玻璃仪器的名称 、 、 ;
(3)实验室制备Cl2的离子方程式为____________________________;
(4)装置③中Cu的作用 (用化学方程式表示);
(5)乙同学认为甲同学实验设计仍然存在缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为此,乙同学提出气体通入装置①之前,要加装一个检验装置⑤,以证明最终通入AgNO3溶液中的气体只有一种。你认为装置⑤应放入 试纸。
(6)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中的AgNO3溶液换成紫色石蕊试液,如果观察到 的现象,则证明制Cl2时有HCl挥发出来
海带成分中碘的检验实验方案设计。
(1)干海带灼烧后,将海带灰放至小烧杯中加入适量蒸馏水,搅拌、煮沸冷却、过滤。将滤液分成四份放入四支试管中,并标为1、2、3、4号。
(2)在1号试管中滴入6滴稀硫酸后,再加入约3 mL H2O2溶液,滴入1%淀粉液1~2滴,观察到溶液立刻由褐色变成蓝色,离子方程式为 。
(3)在2号试管中加入2 mL新制的饱和氯水,振荡溶液,观察现象,离子反应方程式为 。2 min后把加入氯水的溶液分成两份。其中甲中再滴入1%淀粉液1~2滴,观察现象为 ,乙溶液中加入2 mL CCl4,振荡萃取,静置2 min后观察现象为 。
(4)在3号试管中加入食用碘盐3 g,振荡使之充分溶解后滴入6滴稀硫酸。在滴入1%淀粉液1~2滴,观察到溶液立刻由无色变成蓝色,相关的离子方程式为 。
(5)在4号试管中加入硝酸银溶液,振荡,再加入稀硝酸溶液。原想利用反应生成黄色沉淀来检验碘离子。通过实验发现生成白色沉淀。用此方法检验碘元素失败。导致此步失败的可能原因是 。
生铁中含碳和硫等元素。化学兴趣小组对某生铁样品进行了探究。根据要求回答下列问题。
Ⅰ.生铁中碳和硫元素的定性检验
按如图装置进行实验(夹持仪器已略去,填接口字母代号)可以实现碳和硫元素的检验。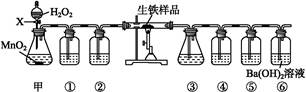
(1)仪器X的名称是 ;装置③⑤中试剂相同,装置④中盛放的试剂是 。
(2)写出甲中反应的化学方程式 。
(3)如果撤除装置③④⑤,能否确认生铁样品中碳元素的存在? ,理由是 。
Ⅱ.生铁中碳、硫质量分数的测定
(4)甲同学认为,以上装置可以粗略测定样品中碳的含量。称取样品w1 g进行实验,充分反应后,测得装置⑥中生成的沉淀为w2 g,该样品中碳的质量分数为 (用含w1、w2的式子表示)。
(5)乙同学认为,待一定量样品充分反应后,向装置④中加入过量氯化钡溶液,根据沉淀质量可以计算样品中硫的质量分数,此方案测得的结果 (填“偏大”或“偏小”);若要提高硫元素含量的测定精度,在不改变实验原理的前提下,可以采取的一种措施是 。
请分析回答某同学在探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铜反应的实验中发现的有关问题。
Ⅰ.探究上述四种酸的氧化性相对强弱及其与铜反应的还原产物的性质
(1)分别向盛有等量铜片的四支试管中加入等体积的浓硫酸、稀硫酸、浓硝酸、稀硝酸,实验结果记录如下表:
| 酸 |
实验结果 |
|
| a |
浓硫酸 |
加热后发生反应,产生无色刺激性气体 |
| b |
稀硫酸 |
加热也不发生反应 |
| c |
浓硝酸 |
不加热即发生反应,产生红棕色气体 |
| d |
稀硝酸 |
微热发生反应,产生无色气体 |
①由上表中实验结果,四种酸的氧化性由强到弱的顺序是 。
②由上表可知,铜与稀硫酸在加热条件下不反应,但若同时通入O2,铜片能逐渐溶解,溶液变为蓝色。写出该反应的化学方程式:
(2)先将铜与浓硫酸反应产生的气体X持续通入如图所示装置中,一段时间后再将铜与浓硝酸产生的气体Y也持续通入该装置中,则整个过程中可观察到的现象包括 (填字母)。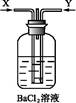
A.通入X气体后产生白色沉淀
B.通入X气体后溶液无明显现象
C.通入Y气体后产生沉淀
D.通入Y气体后沉淀溶解
E.通入Y气体后溶液中无明显现象
由此可得到的结论是 (填字母)。
A.硝酸的酸性比硫酸强
B.H2SO3的酸性比盐酸强
C.HNO3能氧化H2SO3(或SO2)
D.BaSO4既不溶于水也不溶于HNO3溶液
Ⅱ.如图是某同学探究铜与稀硝酸反应的还原产物的实验装置图,请回答下列问题: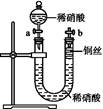
(1)写出铜与稀硝酸反应的离子方程式: 。
(2)已知装置气密性良好,请简述利用该装置证明铜与稀硝酸反应生成的气体产物是NO的操作过程:
某实验小组设计了下列装置进行氨的催化氧化实验。
(1)常温下,用5.8 mol/L的氨水时实验现象明显,现用浓氨水配制该浓度的氨水480mL,需要烧杯、玻璃棒,还需要的玻璃仪器有。
(2)甲处药品的名称为_____________。
(3)实验时,先将催化剂加热至红热,在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明反应是_____(填“吸”或“放”)热反应,化学方程式为;乙处加入无水氯化钙,烧瓶中发生反应的化学方程式为___;锥形瓶中产生的现象为_。
(4)如果缺少乙处的干燥管,将反应后的气体直接通入烧瓶,则烧瓶中产生的现象为。
(5)现用镁与石墨作电极,浓氯化铵溶液作电解液构成原电池,正极的电极反应式为。
某兴趣小组设计并进行了以下实验来制取氯水,并利新制用氯水完成实验。
(1)实验室拟用下列装置制备氯水,请按照气体从左向右流动的方向将仪器进行连接:
H→ _____________(填接口处的符号);广口瓶Ⅱ中的试剂为 。
(2)写出该实验中制取Cl2的化学方程式为:___________________________________
(3)某兴趣小组设计实验除去氯化钾中含有Fe3+、SO42-、Br-等杂质离子,步骤如下:
A.溶解,在所得溶液中加入试剂至Fe3+、SO42-沉淀完全,煮沸;
B.过滤,在滤液中加入盐酸调节pH;
C.加入_____(除Br-);蒸干灼烧。请回答问题:
(3)①步骤a中,依次加入的试剂是NH3.H2O、_________、_________。
②步骤c中加入的试剂是__________________。
(4)某研究性学习小组用KSCN检验FeSO4溶液中的Fe2+时,加入过量浓HNO3,溶液的颜色变红。但是将红色溶液放置一会则发现溶液由红色突然变为蓝色,并产生红棕色气体。对这一奇特现象同学们进行了以下探究。
[查阅资料]:
(SCN)2称为拟卤素,性质与卤素单质相似,(SCN)2、Cl2、Br2、I2四种物质的氧化性强弱为:Cl2>Br2>(SCN)2>I2。
[提出假设]:
①甲同学假设是FeSO4与HNO3作用;乙同学假设是______与HNO3作用。
[实验验证]:
②大家经过理性分析,认为甲同学的假设不成立。理由是________________________。
③根据乙同学的假设,设计了如下实验方案进行验证:向浓HNO3中逐滴加入KSCN溶液,实验开始时无明显现象,一段时间后溶液慢慢变红色至深色,突然剧烈反应产生大量气泡,放出红棕色气体。将产生的气体通入过量的Ba(OH)2溶液,产生浑浊,并剩余一种气体(是空气中的主要成分之一);向反应后的溶液中加入BaCl2溶液产生白色沉淀。
则反应中产生的气体是:_______________________________
[实验结论]:乙同学假设正确。
[实验反思]:
④由实验可知:用SCN-间接检验Fe2+时,加入的氧化剂除用HNO3外还可以选择氯水等,通过该实验探究可知加入氧化剂的量必须要_______(填“少量”、“过量”)。