高铁酸钾(K2FeO4)具有极强的氧化性,可作为水处理剂和高容量电池材料。
(1)FeO42-与水反应的方程式为:4FeO42-+ 10H2O 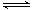 4Fe(OH)3 + 8OH-+ 3O2,
4Fe(OH)3 + 8OH-+ 3O2,
K2FeO4在处理水的过程中所起的作用是________。
(2)与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为____________________________。
(3)将适量K2FeO4配制成c(FeO42-)=1.0×10-3 mol/L(1.0mmol/L)的试样,FeO42-在水溶液中的存在形态如右图所示。下列说法正确的是(填字母)。

A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.改变溶液的pH,当溶液由pH=10降至pH=4的过程中,HFeO4-的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:H2FeO4+OH-=HFeO4-+H2O
D.pH约为2.5 时,溶液中H3FeO4+和HFeO4-比例相当
(4)HFeO4-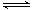 H++FeO42-的电离平衡常数表达式为K=______________,其数值接近_______(填字母)。
H++FeO42-的电离平衡常数表达式为K=______________,其数值接近_______(填字母)。
A.10-2.5 B.10-6 C.10-7 D.10-10
(5)25℃时,CaFeO4的Ksp = 4.536×10-9,若要使100mL1.0×10-3 mol/L的K2FeO4溶液中的c(FeO42-)完全沉淀,则理论上需控制溶液中Ca2+浓度至少为__________。
苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下: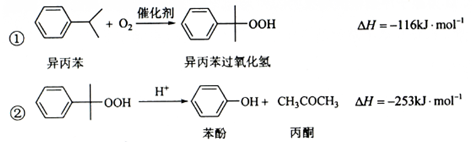
相关化合物的物理常数
| 物质 |
相对分子质量 |
密度(
) |
沸点/℃ |
| 异丙苯 |
120 |
0.8640 |
153 |
| 丙酮 |
58 |
0.7898 |
56.5 |
| 苯酚 |
94 |
1.0722 |
182 |
回答下列问题:
(1)在反应器
中通入的
是。
(2)反应①和②分别在装置和中进行(填装置符号)。
(3)在分解釜
中加入的
为少置浓硫酸,其作用是,优点是用量少,缺点是。
(4)反应②为(填"放热"或"吸热")反应。反应温度控制在50-60℃,温度过高的安全隐患是。
(5)中和釜D中加入的Z最适宜的是(填编号。已知苯酚是一种弱酸)。
a.
b.
c.
d.
(6)蒸馏塔
中的馏出物
和
分别为和,判断的依据是。
(7)用该方法合成苯酚和丙酮的优点是。
酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,
,
和
等组成的糊状填充物,该电池在放电过程产生
,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(
/100
水)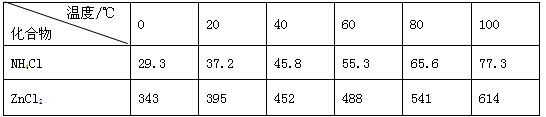
| 化合物 |
|||
|
近似值 |
10-17 |
10-17 |
10-39 |
回答下列问题:
(1)该电池的正极反应式为,电池反应的离子方程式为
(2)维持电流强度为0.5
,电池工作五分钟,理论上消耗
。(已经
=96500
)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有
和
,二者可通过分离回收;滤渣的主要成分是
、和,欲从中得到较纯的
,最简便的方法是,其原理是。
(4)用废电池的锌皮制备
的过程中,需去除少量杂质铁,其方法是:加稀硫酸和
溶解,铁变为,加碱调节至
为时,铁刚好完全沉淀(离子浓度小于1×10-5
时,即可认为该离子沉淀完全);继续加碱调节至
为时,锌开始沉淀(假定
浓度为0.1
)。若上述过程不加
后果是,原因是。
具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比
高效,且腐蚀性小。请回答下列问题:
(1)
净水的原理是。
溶液腐蚀钢铁设备,除
作用外,另一主要原因是(用离子方程式表示)。
(2)为节约成本,工业上用
氧化酸性
废液得到
。
①若酸性
废液中
=2.0×10-2
·
,
=1.0×10-3
·
,
=5.3×10-2
·
,则该溶液的
约为。
②完成
氧化
的离子方程式:
+
+=
+
+
(3)
在溶液中分三步水解:
+
 +
+
+
![]() +
+
+
 +
+
以上水解反应的平衡常数
、
、
由大到小的顺序是。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:
+

欲使平衡正向移动可采用的方法是(填序号)。
.降温
.加水稀释
.加入NH4Cl
.加入
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是。
(4)天津某污水处理厂用氯化铁净化污水的结果如下图所示。由图中数据得出每升污水中投放聚合氯化铁[以
·
表示]的最佳范围约为
·
。
为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以
存在)转变成重要的化工原料
(反应条件略)。
活化硫铁矿还原
的主要反应为:
,不考虑其他反应。请回答下列问题:
(1)第Ⅰ步
与
反应的离子方程式是。
(2)检验第Ⅱ步中
是否完全还原,应选择(填字母编号)。
A.
溶液B.
溶液 C.
溶液
(3)第Ⅲ步加
调溶液
到5.8左右,然后在第Ⅳ步通入空气使溶液
降到5.2,此时
不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液
降低的原因是。
(4)
可转化为
,
在空气中加热反应可制得铁系氧化物材料。
已知25℃,101
时:
在空气中加热反应生成
的热化学方程式是。
(5)
在一定条件下可制得
(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为
,正极反应式是。
(6)假如烧渣中的铁全部视为
,其含量为50%。将
质量分数为
%的硫酸加入到
烧渣中浸取,铁的浸取率为96%,其他杂质浸出消耗的硫酸以及调
后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第Ⅲ步应加入
。
| 1. |
对溴苯乙烯与丙烯的共聚物是一种高分子阻燃剂,具有低毒、热稳定性好等优点。完成下列填空: |
| 2. |
实验室由乙苯制取对溴苯乙烯,需先经两步反应制得中间体 |
| 3. |
将 |
| 4. |
丙烯催化二聚得到2,3-二甲基-1-丁烯,B与2,3-二甲基-1-丁烯互为同分异构体,且所有碳原子处于同一平面。 |